¿Qué es la calorimetría?
Como hemos explorado anteriormente, la calorimetría es un método utilizado para medir el cambio de entalpía de la reacción. En otras palabras, mide el cambio de calor de una reacción. Sin embargo, es imposible medir el cambio de calor directamente. En su lugar, tenemos que medir el cambio detemperatura causado por el calor.
Latemperatura y el calor son cosas distintas. El calor es una forma de energía. Es la suma total de todas las energías de las partículas de una sustancia. Como todos los tipos de energía, se mide en julios (J) o kilojulios (kJ). Por otra parte, la temperatura es una medida de energía. Tiene que ver con la energía media de las partículas de una sustancia y se mide en kelvin (K), grados Celsius(°C) o grados Fahrenheit(°F). También se puede decir que la temperatura es simplemente una medida de lo caliente o frío que está algo.
Una cosa importante a tener en cuenta es que el calor está relacionado con el número de partículas de una sustancia, mientras que la temperatura no lo está. Si hay más partículas en una sustancia, aumenta el almacén total de energía y, por tanto, aumenta su calor. Sin embargo, su energía media no cambiará necesariamente, por lo que la temperatura puede seguir siendo la misma.
La energía térmica siempre fluye de una temperatura más alta a una más baja, es decir, de una sustancia caliente a una fría. Cuando calientas una sustancia, le transfieres energía. Esto puede provocar un aumento de la temperatura. Pero también puede provocar un cambio de estado. Pero siempre que la sustancia permanezca en el mismo estado, esto significa que el cambio de temperatura es una forma práctica de medir el cambio de calor. En otras palabras, es una forma de medir el cambio de entalpía.
Tipos de calorimetría
Hay algunos tipos diferentes de calorimetría:
- Calorimetría directa
- Calorimetría indirecta
- Calorimetría diferencial de barrido
Para tus exámenes, sólo necesitas conocer la calorimetría directa. Por lo general, la gente se refiere a ella cuando habla de calorimetría y, a menos que digamos lo contrario, es a lo que nos referimos cuando hablamos de calorimetría en el resto de este artículo. Sin embargo, hemos incluido a continuación los otros tipos de calorimetría como ejemplos adicionales de interés.
Calorimetría directa
La calorimetríadirecta, como su nombre indica, mide el cambio de calor de una reacción química midiendo directamente el cambio de temperatura que provoca. Para ello se utiliza un calorímetro.
Un calorímetro es una herramienta utilizada para medir el cambio de entalpía de una reacción química.
Se puede fabricar un calorímetro sencillo con un vaso de poliestireno, agua y un termómetro. La reacción que nos interesa libera energía calorífica que calienta el agua. La idea es que minimicemos la pérdida de calor y midamos el cambio de temperatura del agua, y luego lo utilicemos para calcular el cambio de entalpía de la reacción.
En biología, la calorimetría directa se refiere generalmente a la medición del cambio de calor de un organismo vivo colocándolo en una cámara sellada y midiendo el cambio de temperatura del aire circundante.
Calorimetría indirecta
Lacalorimetría indirecta es un término utilizado en biología. Es una forma de medir el cambio de calor de un organismo midiendo su ingesta de oxígeno o su producción de dióxido de carbono o nitrógeno.
Calorimetría diferencial de barrido
Cada sustancia necesita una cantidad diferente de energía térmica para elevar su temperatura. La calorimetría difer encial de barrido es una técnica utilizada para medir la diferencia en la cantidad de energía necesaria para elevar la temperatura de una muestra y una sustancia de referencia en la misma cantidad. Se utiliza a menudo en biología para averiguar la capacidad calorífica específica de diversas proteínas y otras moléculas biológicas, e investigar su respuesta al calentamiento.
Ecuación de la calorimetría
Como ya hemos explicado, el objetivo de la calorimetría es medir el cambio de entalpía de una reacción. Para ello, medimos el cambio de temperatura de otra sustancia que provoca una reacción. Llamemos a esta sustancia X. La temperatura y la entalpía se relacionan mediante la siguiente ecuación:
En esta ecuación
- q es el cambio de entalpía de la reacción, medido en J.
- m es la masa de X, medida en g.
- c es la capacidad calorífica específica de X, medida en J g-1 K-1.
- ΔT es el cambio de temperatura de X, medido en K.
La capacidad calorífica específica, c, es la energía necesaria para elevar un kelvin la temperatura de un gramo de una sustancia. Se mide en julios por gramo y por kelvin, .
Puedes leer más sobre la capacidad calorífica específica en nuestro artículo Física térmica.
No te preocupes: practicaremos el uso de esta ecuación dentro de un momento. Pero de momento, pasemos al tema principal de este artículo: realizar una calorimetría.
Experimento de calorimetría
Ya hemos explorado un tipo de calorímetro. Consiste en un vaso de poliestireno lleno de agua u otra solución. La energía calorífica liberada por una reacción se utiliza para calentar el agua y se mide el cambio de temperatura del agua. Ahora vamos a ver con más detalle cómo puedes utilizar la calorimetría para calcular las entalpías de reacción, de neutralización y de combustión.
Recuerda:
El cambio de entalpía de reacción es el cambio de entalpía cuando cantidades iguales de reactivos reaccionan para formar productos, con todas las especies en sus estados estándar y en condiciones estándar.
El cambio de entalpía de neutralización es el cambio de entalpía cuando un ácido y un álcali reaccionan juntos para formar un mol de agua, en condiciones estándar.
El cambio de entalpía de la combustión es el cambio de entalpía cuando un mol de una especie arde completamente en oxígeno, con todas las especies en sus estados estándar y en condiciones estándar.
Las condiciones estándar implican una presión de 100 kPa y 298 K. Los estados estándar son los estados en los que se encuentra una especie, en estas condiciones.
Si es la primera vez que te enfrentas a las entalpías, te recomendamos que visites Cambios de entalpía para obtener información más detallada.
Calcular la entalpía de reacción
En las reacciones en las que se mezclan dos soluciones o se añade un sólido a una solución, puedes calcular la entalpía de reacción mediante calorimetría. Para ello, mezcla las dos soluciones o añade el sólido a la solución y mide el cambio de temperatura de la solución. En este ejemplo, añadiremos un sólido a una solución acuosa. Éste es el método:
- Enjuaga un vaso de poliestireno y una probeta en la solución que vayas a utilizar, y luego sécalos bien.
- Mide 50 cm3 de la solución y viértelos en el vaso de poliestireno. Coloca el vaso en un vaso de precipitados y ponle una tapa encima.
- Pesa aproximadamente 2,00 g de tu reactivo sólido en un bote de pesas.
- Introduce un termómetro por un agujero de la tapa. Mide la temperatura de la solución cada 30 segundos durante tres minutos.
- Al tercer minuto, no midas la temperatura, sino que añade el reactivo sólido a la solución. Vuelve a pesar el bote de pesaje para ver si queda algún sólido, y réstalo del peso inicial.
- Mide la temperatura de la solución cada 30 segundos durante 5 minutos, o hasta que la temperatura se mantenga constante.
Si quieres mezclar dos soluciones acuosas, dosifica cada una de ellas en probetas distintas, ambas enjuagadas en su solución respectiva. Vierte la primera solución en el vaso de poliestireno. Mide la temperatura de ambas soluciones cada 30 segundos. A los tres minutos, añade la segunda solución a la primera y sigue midiendo su temperatura cada 30 segundos como en el método anterior.
Hallar el cambio de entalpía
Ahora necesitamos hallar el cambio de temperatura de la reacción, ya que podemos utilizarlo para calcular el cambio de entalpía de la reacción. Sin embargo, no tenemos un valor de temperatura para el momento exacto en que añadimos el sólido e iniciamos la reacción. El punto de adición es a los 3 minutos, mientras que nuestro primer punto de datos está en la marca de los 3 minutos y 30 segundos. Para averiguar el aumento exacto de temperatura de la reacción, primero tenemos que trazar una gráfica de la temperatura de la solución en función del tiempo y extrapolar la temperatura hasta el punto de adición. ¿Suena confuso? A continuación te explicamos cómo hacerlo.
Se añaden 2,00 g de zinc a 50 cm3 de una solución de sulfato de cobre de 0,2 mol dm-3 y se obtienen los siguientes datos. El zinc se añade a los 180 segundos.
 Valores de los datos de un experimento de calorimetría. Anna Brewer, StudySmarter Originals
Valores de los datos de un experimento de calorimetría. Anna Brewer, StudySmarter Originals
Calcula la entalpía de reacción. Puedes suponer que la solución de sulfato de cobre tiene una densidad de y una capacidad calorífica específica de .
Para calcular el cambio de entalpía de la reacción, necesitamos utilizar la ecuación que hemos discutido antes: . ¿Qué valores conocemos?
Bien, m se refiere a la masa de la solución que se calienta, en este caso, la solución de sulfato de cobre. El sulfato de cobre tiene una densidad de por lo que nuestra solución pesa 50 g. c se refiere a la capacidad calorífica específica de la solución de sulfato de cobre, que se indica en la pregunta: . Sólo necesitamos hallar ΔT, el cambio total de temperatura de la reacción. Para ello, vamos a representar nuestros puntos en un gráfico. Pon la temperatura en el eje y y el tiempo en el eje x. Deberías obtener algo como esto
 Puntos de datos de un experimento calorimétrico trazados en un gráfico. Anna Brewer, StudySmarter Originals
Puntos de datos de un experimento calorimétrico trazados en un gráfico. Anna Brewer, StudySmarter Originals
Ahora tenemos que trazar dos líneas de mejor ajuste: una antes de añadir el zinc en la marca de los 3 minutos, y otra después. Observa que no hay ningún punto de datos en la marca de los 3 minutos. En su lugar, extrapolamos nuestras líneas hasta ese punto. Puedes verlo a continuación:
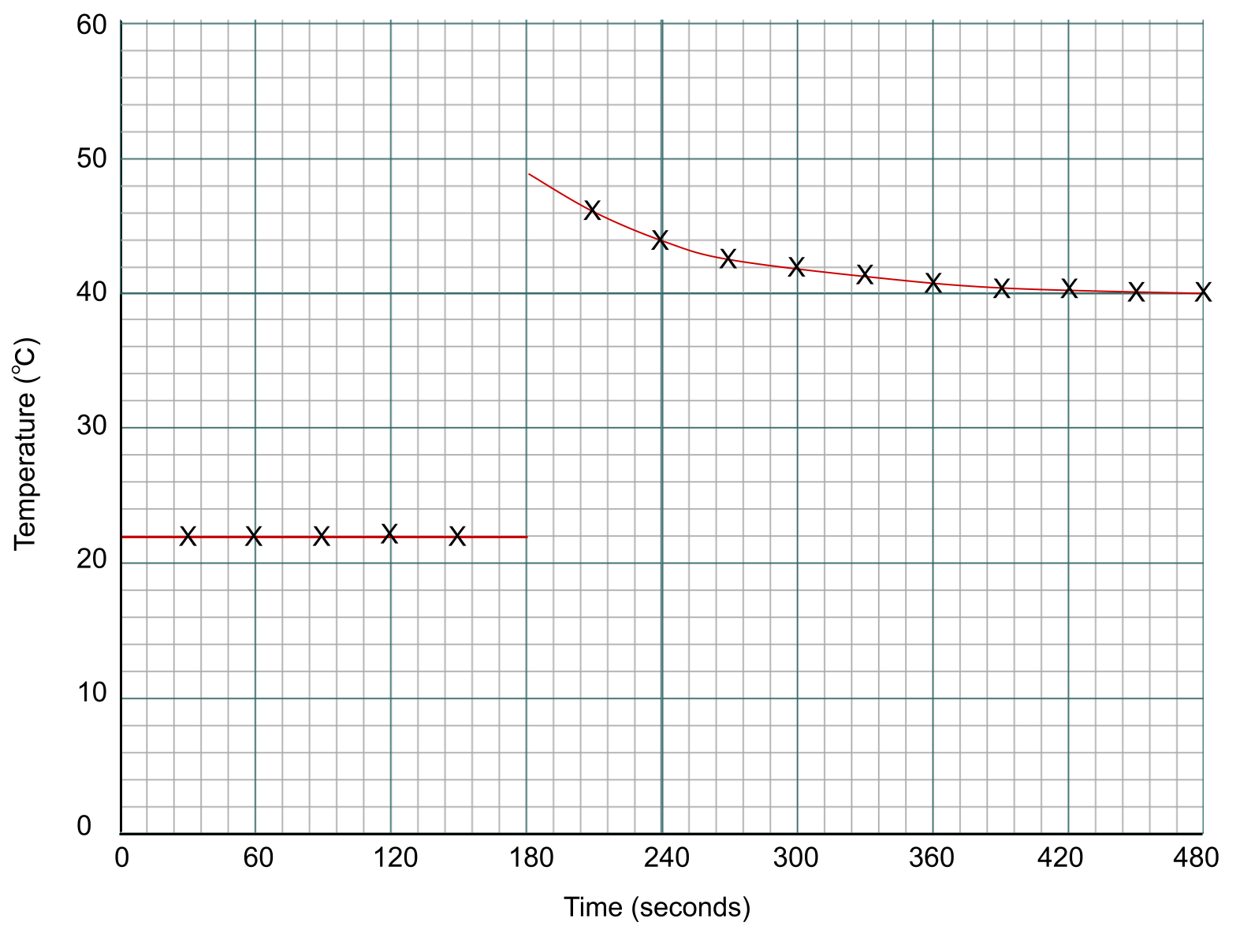
Puntos de datos de un experimento de calorimetría trazados en un gráfico. Anna Brewer, StudySmarter Originals
Para hallar el cambio de temperatura de la reacción, medimos la diferencia entre las dos líneas en el punto de adición, que es la marca de los 3 minutos.
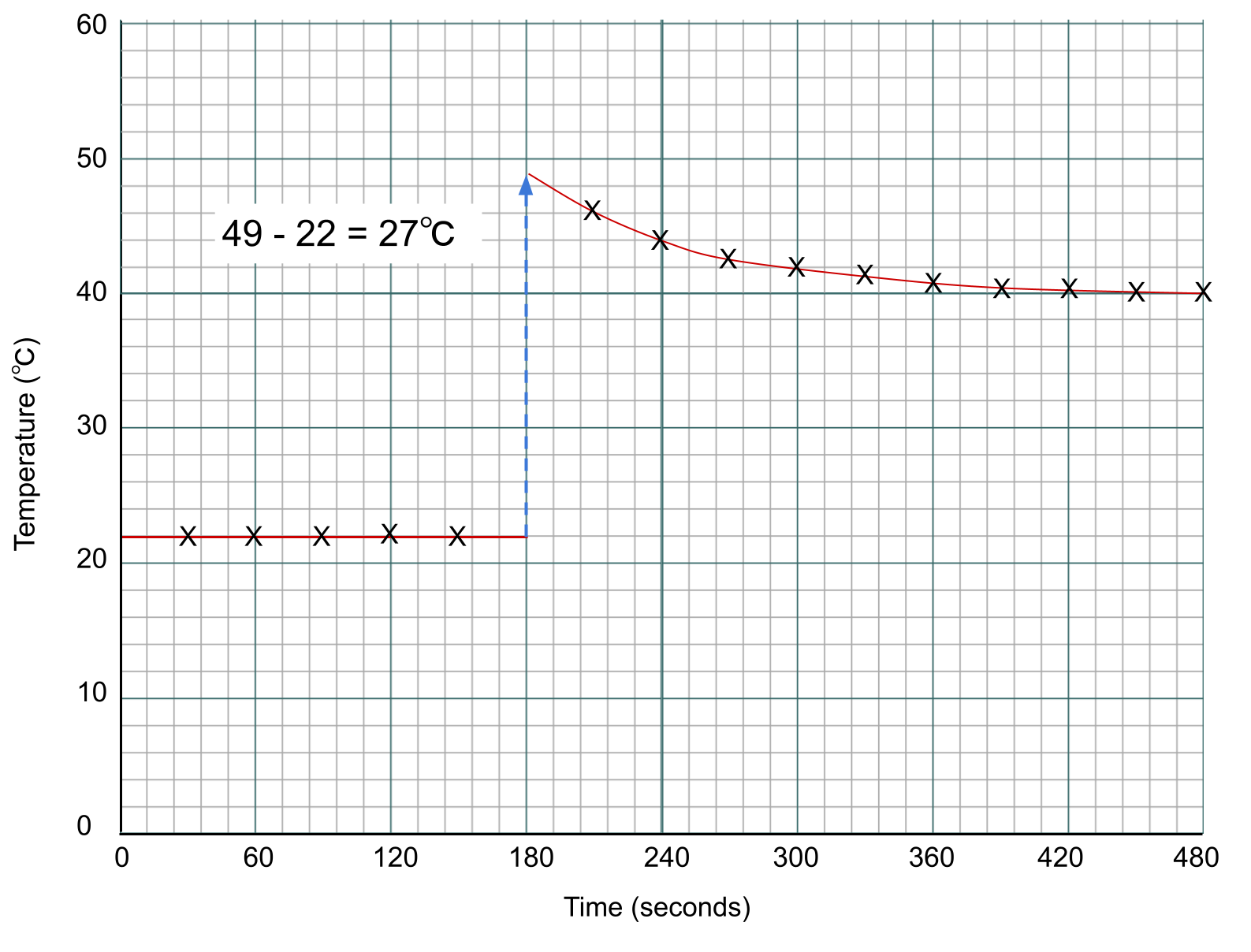
Puntos de datos de un experimento calorimétrico representados en un gráfico. Anna Brewer, Originales de StudySmarter
Te habrás dado cuenta de que hemos medido la temperatura en ℃, pero la ecuación para el cambio de entalpía necesita la temperatura en K. Sin embargo, sólo nos interesa el cambio de temperatura . Un cambio de 1 ℃ es lo mismo que un cambio de 1 K, por lo que aquí las unidades son intercambiables.
Ahora podemos sustituir todos estos valores en la ecuación:
Sin embargo, ésta no es la respuesta definitiva. Tenemos que hacer dos cosas más.
En primer lugar, simplemente hemos calculado el cambio de entalpía. La pregunta ha pedido la entalpía de reacción, que se da en kJ por mol. Tenemos que calcular cuántos moles de zinc han reaccionado y dividir el cambio de entalpía que hemos calculado por este número. El zinc tiene un número atómico de 65,4, y en la pregunta tenemos 2,00 gramos. Por tanto, tenemos . .
Por último, se trata de una reacción exotérmica. En general, se liberó energía. Por tanto, la respuesta final necesita un signo negativo delante: .
Hallar la entalpía de neutralización
La entalpía de neutralización funciona exactamente igual que la entalpía de reacción. Combinas tus dos reactivos, ya sean soluciones o un sólido y una solución, y registras el cambio de temperatura durante varios minutos. A continuación, trazas un gráfico y lo extrapolas al punto de adición para encontrar una temperatura máxima. A continuación, calcula el cambio de temperatura y calcula el cambio de entalpía, como se ha descrito anteriormente.
Hallar la entalpía de combustión
Para las reacciones que implican combustión, podemos calcular la entalpía de combustión mediante calorimetría. Para ello, quemamos un combustible debajo de un vaso de precipitados con agua y medimos el cambio de temperatura del agua. El procedimiento es el siguiente
- Mide una masa conocida de agua fría en una lata de cobre.
- Suspende la lata de cobre por encima de un quemador de combustible utilizando un soporte y una pinza o un trípode.
- Mide la temperatura del agua y la masa del quemador de combustible.
- Enciende el quemador de combustible y déjalo arder hasta que la temperatura del agua haya aumentado aproximadamente 25 ° C. Sigue midiendo la temperatura, ya que podría seguir aumentando después de apagar el combustible.
- Mide de nuevo la masa del quemador de combustible y réstala de su masa inicial para hallar el cambio de masa del quemador de combustible.
Hallar el cambio de entalpía
Encontrar la entalpía de combustión es más fácil que encontrar la entalpía de reacción. Puedes hallar fácilmente el cambio de temperatura restando la temperatura inicial del agua de la temperatura máxima que alcanza. A partir de ahí, sólo tienes que sustituir tus valores en la ecuación que hemos utilizado antes, . Veamos un ejemplo.
0,5 g de propan-2-ol arden completamente, calentando 150 g de agua. La temperatura del agua aumenta de 21 ℃ a 50 ℃. Calcula el cambio de entalpía de combustión para la reacción. La capacidad calorífica específica del agua es .
En primer lugar, debemos calcular el cambio de entalpía de la reacción. Aquí, m = 150 y c = 4,18. Para hallar ΔT, el cambio de temperatura, restamos la temperatura inicial de la temperatura final. Aquí, ΔT = 50 - 21 = 29 ℃. Introduciendo todos estos valores en la ecuación de la entalpía obtenemos lo siguiente:
Sin embargo, la entalpía de combustión se mide en kilojulios por mol. Ahora tenemos que dividir el cambio de entalpía por el número de moles de etanol quemados. El etanol tiene una masa relativa de fórmula de 46. Por tanto, tenemos moles de etanol. Por tanto, la entalpía de combustión del etanol es . Pero aún no hemos terminado: una vez más, éste es un ejemplo de reacción exotérmica, por lo que necesitamos un signo negativo delante de la respuesta. Nuestra respuesta final es .
Limitaciones de la calorimetría
La calorimetría puede ser extremadamente frustrante. Puedes seguir un método idéntico al de tu compañero pero obtener resultados extremadamente diferentes. Esto se debe a que hay muchas variables que entran en juego durante la calorimetría y es imposible controlarlas todas con precisión. Por ejemplo:
- Puede haber transferencia de energía hacia o desde el entorno, normalmente en forma de pérdida de calor.
- Siempre suponemos que la solución utilizada tiene la capacidad calorífica específica y la densidad del agua pura, pero podría no ser así.
- La reacción podría ser incompleta.
- Parte de la energía calorífica liberada podría calentar el aparato en lugar de la propia solución.
- Parte del combustible podría evaporarse.
Sin embargo, hay formas de minimizar la variación de los resultados. La mayoría de ellas consisten en minimizar la pérdida de calor al medio ambiente. Algunos ejemplos son:
- Al medir la entalpía de reacción, colocas la solución reaccionante dentro de un vaso de poliestireno, que a su vez se coloca dentro de un vaso de precipitados. De este modo se aísla la solución.
- Al medir la entalpía de combustión, puedes utilizar un paravientos para proteger el quemador de combustible de cualquier corriente de aire. También deberías mantener el vaso de agua a una distancia fija por encima del quemador, para que tus resultados sean más reproducibles.
- En ambos casos, puedes colocar una tapa sobre el vaso de precipitados o de poliestireno, para mejorar el aislamiento y minimizar las pérdidas de calor.
Calorimetría - Puntos clave
La calorimetría es un método para medir el cambio de entalpía de una reacción midiendo el cambio de temperatura que provoca la reacción.
Se puede fabricar un calorímetro sencillo con un vaso de poliestireno, agua y un termómetro. Utilizamos la energía calorífica liberada por la reacción para calentar el agua y utilizamos el cambio de temperatura del agua para calcular el cambio de entalpía de la reacción.
El cambio de entalpía, la masa, la capacidad calorífica específica y el cambio de temperatura están relacionados por la ecuación .
Puedes utilizar la calorimetría para medir la entalpía de reacción, la entalpía de neutralización y la entalpía de combustión.











