¿Qué ha ocurrido? Lo que has presenciado se llama cambio de fase. En este artículo aprenderemos todo sobre los cambios de fase y veremos por qué y cómo se producen.
Este artículo trata sobre los cambios de fase .
- En primer lugar, conoceremos los fundamentos de las fases y aprenderemos la definición de los cambios de fase.
- Después, veremos algunos ejemplos de cambios de fase.
- A continuación, veremos los diagramas de fases y aprenderemos a interpretarlos.
- Por último, aprenderemos cómo se transfiere la energía durante los distintos cambios de fase.
Definición de cambio de fase
La materia puede existir en varias formas llamadas fases o estados. Éstas son
Sólidos
Líquidos
Gases
La cantidad de energía de una especie determina su fase. A continuación se muestra un diagrama con el aspecto de cada fase:
 Fig. 1 - Las partículas están espaciadas de forma diferente en cada estado de la materia
Fig. 1 - Las partículas están espaciadas de forma diferente en cada estado de la materia
Aquí tienes un desglose de lo que significa cada ilustración:
- Sólido las partículas se mantienen firmemente en posiciones fijas y están en contacto constante unas con otras. Tienen suficiente energía para vibrar en su sitio.
- Las partículaslíquidas siguen estando muy juntas y en contacto constante, pero tienen energía suficiente para cambiar de posición entre sí.
- Gas Las partículas tienen energía suficiente para moverse libremente. Sólo entran en contacto ocasionalmente cuando chocan entre sí.
Cuando las especies ganan o pierden suficiente energía, pueden sufrir un cambio de fase.
Un cambio de fase es un proceso físico en el que una sustancia cambia de estado. Este cambio suele producirse a una temperatura denominada punto de ebullición o punto de fusión.
El punto de ebullición es la temperatura a la que un líquido se convierte en gas O un gas se convierte en líquido (en su lugar se denomina punto de condensación). Si un líquido gana suficiente energía para que las moléculas se separen, está en ebullición. Si un gas pierde energía para reformarse en un estado más confinado, se está condensando.
El punto de fusión es la temperatura a la que un sólido se convierte en líquido O un líquido se convierte en sólido (en su lugar se denomina punto de congelación). Si un sólido gana suficiente energía para alterar las fuerzas entre las partículas, se está fundiendo. Si un líquido pierde suficiente energía para que estas fuerzas se fortalezcan lo suficiente como para reformarse, se está congelando.
Puesto que en estos puntos se produce un cambio de fase, ambas fases (sólido/líquido o líquido/gas) pueden existir a esa temperatura. Hablaremos de ello con más detalle más adelante.
Existe un cuarto estado de la materia, menos común, llamado plasma. El plasma tiene la mayor energía de todos los estados de la materia. En la forma de plasma, los electrones vagan alrededor de los distintos núcleos de los átomos. La formación del plasma suele deberse a la ionización de un gas. La transición del plasma a un gas se denomina recombinación.
Cambio de fase por sublimación
Aunque la mayoría de los cambios de fase implican un líquido en algún momento, hay un par de cambios de fase que se saltan por completo la fase líquida. Uno de ellos se conoce como sublimación.
La sublimación es el proceso por el que un sólido se convierte en gas sin pasar antes a líquido. El proceso inverso (de gas a sólido) se denomina deposición.
Probablemente hayas visto la sublimación en acción si alguna vez has visto "hielo seco" (CO2 sólido). A temperatura ambiente, el hielo seco sublima pasando de sólido a gas, por eso aparece como humo.
Ejemplos de cambio de fase
Ahora que hemos aprendido lo básico sobre los cambios de fase, veamos algunos ejemplos. Hay 6 cambios de fase en total:
Fusión (sólido \( \rightarrow \) líquido)
Solidificación/Fusión (líquido \( \rightarrow \) sólido)
Hervir (líquido \( \ flecha \) gas)
Condensación (gas - líquido)
Sublimación (sólido \( \rightarrow \) gas)
Deposición (gas - flecha - sólido)
Diagrama de cambio de fase
Curiosamente, cuando se produce un cambio de fase, la temperatura no cambia. En cambio, el calor que se añade o se resta se utiliza para que se produzca el cambio de fase.
A continuación se muestra el diagrama de cambio de fase del agua:
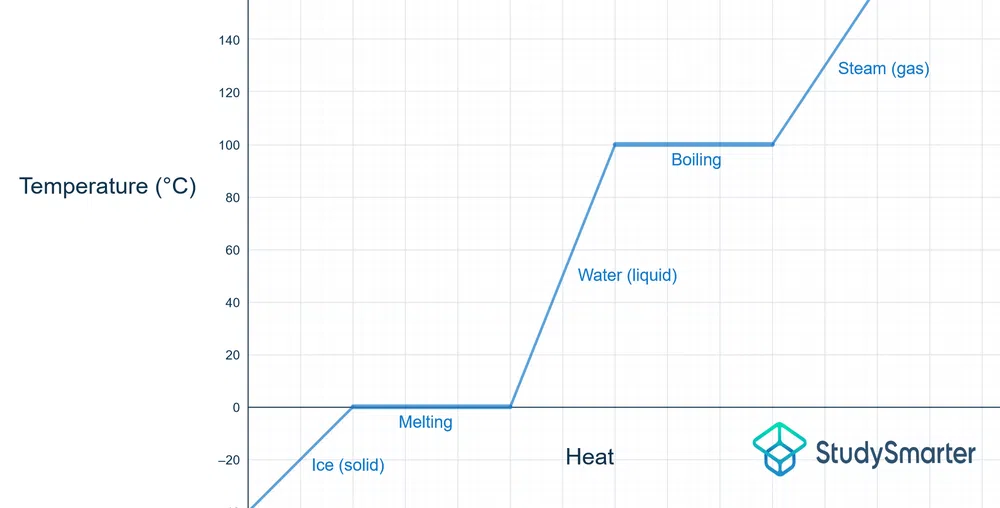
Fig. 2 - Diagrama de cambio de fase y temperatura del agua
El punto de fusión del agua es 0 °C, y puedes ver que, una vez alcanzada esa temperatura, se estabiliza un poco. El calor que se añade se utiliza para separar las partículas de hielo hasta que se convierten en agua (es decir, en fase líquida).
El mismo proceso ocurre a 100 °C, el punto de ebullición del agua. La energía térmica que se añade está separando las moléculas de agua para que se conviertan en vapor (es decir, fase gaseosa).
Cuando se produce el proceso inverso (de líquido a sólido, de gas a líquido), la temperatura permanece invariable mientras se produce el cambio de fase h. Se está liberando calor/energía, por lo que las partículas acaban más juntas.
Como ya se ha dicho, en el punto de ebullición/punto de fusión, ambas fases pueden existir a esa temperatura. Una vez alcanzada la temperatura necesaria, es necesario añadir una cierta cantidad de calor para que se produzca un cambio de fase completo. Antes de que eso ocurra, existe un sólido+líquido o un líquido+gas, ya que uno se está convirtiendo en el otro.
La temperatura a la que algo hierve/funde depende de la presión. Cuando nos referimos al punto de ebullición/fusión del agua, nos referimos a estos puntos a 1 atm (atmósfera a nivel del mar). Sin embargo, el punto de ebullición/fusión cambiará en función de la presión.
A continuación se muestra un diagrama de fases para elCO2 (dióxido de carbono).
 Fig. 3 - Cambios de fase del dióxido de carbono.
Fig. 3 - Cambios de fase del dióxido de carbono.
La frontera entre cada fase representa dónde se producirá ese cambio de fase. A presión estándar (1 atm), y temperatura ambiente (~20 °C), el dióxido de carbono es un gas/vapor, pero a temperaturas muy bajas es sólido. Esto explica por qué el hielo seco se sublima en lugar de fundirse El gráfico anterior también nos muestra dos puntos importantes:1. El punto triple2. El punto crítico. El punto crítico
El punto triple es donde coexisten las tres fases en equilibrio.
Esencialmente, el punto triple es una encrucijada, donde puedes elegir cualquier dirección (para llegar a cualquier fase). Supongamos que tenemos una muestra de hielo seco a 5,2 atm y -100 °C. Al aumentar la temperatura y alcanzar los -57 °C, el hielo seco empezará a convertirse enCO2 líquido y gaseoso.
Si la temperatura sigue aumentando, el hielo seco se convertirá completamente en gas. Sin embargo, si aumenta la presión, el hielo seco se convertirá en líquido.
El punto crítico es aquel en el que una especie se convierte en un fluido supercrítico.
Un fluido supercrítico es una sustancia en la que no hay distinción entre las fases líquida y gaseosa.
El punto crítico es esencialmente el "punto final" de la curva del punto de ebullición (frontera entre líquido y gas). Después de este punto, no puede producirse la ebullición. La especie tiene características combinadas de líquido y gas, por lo que es difícil diferenciar entre ambos. La conversión de un líquido a un gas no puede producirse, puesto que la especie ya no es un líquido ni un gas.
Energía de los cambios de fase
Cada cambio de fase tiene asociada su propia energía. Para todas las moléculas/elementos, se necesita una cantidad determinada de energía para que se produzca un cambio de fase. El calor necesario para que se produzca la ebullición se denomina calor de vaporización (ΔHvap), mientras que el calor necesario para la fusión es el calor de fusión (ΔHfus).
Aunque la magnitud es la misma, los signos de cada uno dependen de la dirección del cambio de fase. Si se está añadiendo calor, ΔHvap y ΔHfus son positivos, mientras que son negativos si se está liberando calor.
Estos valores dependen de las interacciones entre las moléculas. Si las moléculas tienen fuerzas fuertes entre ellas, se necesitará más energía para cambiar su estado.
Aquí tienes una tabla con algunos valores comunes de los calores de vaporización/fusión.
| Nombre de la sustancia | ΔHfus (J/g) | ΔHvap (J/g) |
| Agua | 334 | 2260 |
| Etanol (C2H5OH) | 109 | 838 |
| Oxígeno | 14 | 213 |
| Metano (CH4) | 59 | 537 |
| Hierro | 209 | 6340 |
| Nitrógeno | 25.5 | 200 |
El calor total necesario se basa en la masa de las especies. La fórmula para el cambio de calor es
$$ \text{calor}=m*\Delta H_{x} \quad o \quad \text{calor}=n*\Delta H_{x} $$
Donde m es la masa de la especie, n es el número de moles de la especie y \(\Delta H_{x}\) es el calor de vaporización o el calor de fusión.
Intentemos un problema de ejemplo:
Se necesitan 679 J para vaporizar una muestra de nitrógeno líquido. Si el ΔHvap = 200 J/g, ¿cuántos gramos de nitrógeno había en la muestra?
La fórmula que utilizaríamos es: $$\text{heat}=m*\Delta H_{vap}$$ Para obtener la masa de la muestra, tenemos que dividir el calor necesario para vaporizar la muestra por el calor de vaporización.
$$\frac{\text{heat}}{\Delta H_{vap}}=m$$
$$\frac{679\,J}{200\frac{J}{g}}=m$$
$$m=3,4\,g$$
Hagamos un ejemplo más utilizando la otra fórmula:
Se necesitan 11.239 J para fundir una muestra de galio. Si el ΔHfus = 5,59 kJ/mol, ¿cuántos moles de galio había en la muestra?
Como estamos buscando el número de moles de una muestra fundida, utilizaríamos esta fórmula
$$\text{heat}=n*\Delta H_{fus}$$
En primer lugar, tenemos que convertir nuestro calor en kJ, ya que es la unidad en la que está expresado nuestro calor de fusión.
$$11,239\,J*\frac{1\,kJ}{1000\,J}=11.239\,kJ$$
Ahora podemos introducir nuestras variables y resolver para n (número de moles)
$$\text{heat}=n*\Delta H_{fus}$$
$$n=\frac{\text{heat}}{\Delta H_{fus}$$
$$n=\frac{11.239\,kJ}{5.59\frac{kJ}{mol}}$$
$$n=2,01\$$,mol$$
Cambios de fase endotérmicos
Como ya hemos dicho, los cambios de fase se deben a una ganancia o a una liberación de calor. Los cambios de fase provocados por una ganancia de calor se denominan cambios de fase endotérmicos (ΔH > 0). Son los siguientes
Ebullición (líquido --> gas)
Fusión (sólido --> líquido)
Sublimación (sólido --> líquido)
Los cambios de fase exotérmicos son lo contrario. En estos cambios de fase se libera calor (ΔH < 0). Éstos son
Condensación (gas --> líquido)
Solidificación (líquido --> gas)
Deposición (gas --> sólido)
Cambios de fase - Puntos clave










