Conocer la composición de las especies de una mezcla también es importante para los químicos. En este artículo nos adentraremos en el concepto de mezcla y aprenderemos a calcular la composición.
- Este artículo trata sobre la composición de las mezclas.
- En primer lugar, definiremos una mezcla y sus dos tipos: homogénea y heterogénea.
- A continuación, trataremos los distintos métodos de separación
- A continuación, veremos cómo calcular la composición de una mezcla
- Por último, explicaremos el concepto de mezcla de gases y cómo calcular la presión parcial.
Definición de mezcla
Antes de hablar de los distintos tipos de mezclas, debemos definir qué es una mezcla .
Una mezcla es una combinación de dos o más sustancias en cualquier proporción. Las sustancias de una mezcla conservan sus propiedades originales y no sufren una reacción química para mezclarse.
Vemos diferentes tipos de mezclas todos los días, desde ensaladas hasta agua salada, ¡e incluso el aire que respiramos son todas mezclas! Hay dos tipos de mezclas: homogéneas y heterogéneas. Primero explicaremos las mezclas homogéneas.
Mezclas homogéneas
Las mezclas homogéneas son un tipo de mezcla en el que la composición es uniforme.
Un buen ejemplo de mezcla homogénea es el agua salada. Cuando la sal se disuelve, se dispersa uniformemente por el agua. La cantidad de sal que se disuelve en el agua puede cambiar, pero la distribución es la misma.
Aquí tienes un diagrama para ilustrarlo:
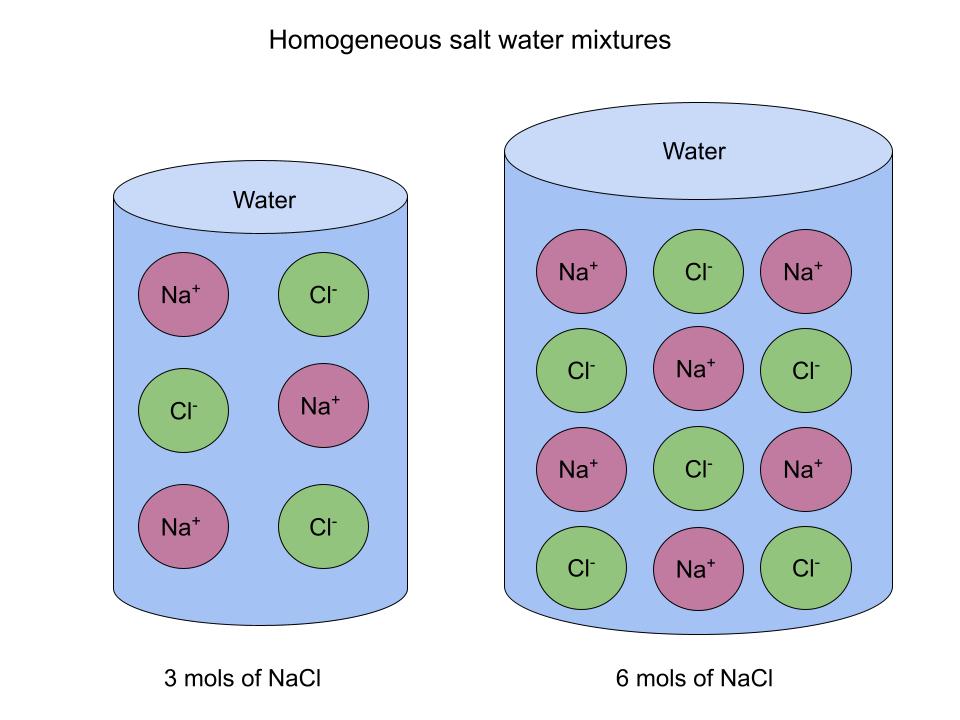
Elagua salada es una mezcla homogénea independiente de laconcentración de sal. StudySmarter Original
Aunque cada mezcla tenga una concentración diferente de sal, la distribución es la misma. Si cortas cada muestra por la mitad, la composición dentro de cada una sería la misma para ambas mitades.
Mezclas heterogéneas
Hablemos ahora de las mezclas heterogéneas.
Lasmezclas heterogéneas son mezclas en las que la composición no es uniforme.
Las muestras heterogéneas se componen de dos o más fases. Un gran ejemplo de mezcla heterogénea son las galletas con pepitas de chocolate. La distribución de las pepitas de chocolate es esencialmente aleatoria.
Una fase es cualquier parte de una muestra que sea uniforme. Por ejemplo, si mezclas aceite y agua, tendrás dos fases separadas: aceite y agua.
Considera las galletas de chocolate como ejemplo, las dos fases son la galleta y las pepitas de chocolate. La galleta y las pepitas de chocolate individualmente se consideran homogéneas, ya que sus ingredientes son uniformes (por ejemplo, la galleta tiene una mezcla homogénea de harina, huevo, azúcar, etc.). Sin embargo, cuando se combinan, forman una mezcla heterogénea.
Separación de mezclas
A diferencia de los compuestos químicos, las mezclas pueden separarse utilizando medios no químicos. Los métodos de separación se basan en los distintos atributos físicos de cada componente, como la densidad, el punto de ebullición y el tamaño de las partículas.
Hay 4 formas habituales que utilizan los químicos para separar mezclas:
Evaporación
Destilación
Filtración
Separación mediante un embudo de separación
En primer lugar, tenemos la evaporación. Esta técnica se utiliza normalmente para separar un disolvente líquido (sustancia que se disuelve) y un soluto sólido (sustancia disuelta). El disolvente se evapora y el soluto queda en estado sólido.
Lo siguiente es la destilación. Este proceso se centra en las diferentes volatilidades (probabilidad de evaporarse) de los distintos líquidos de la mezcla. A continuación se muestra el aspecto de un aparato de destilación:
 Experimento de destilación. Wikimedia commons.
Experimento de destilación. Wikimedia commons.
Se coloca la mezcla en el matraz de fondo redondo y se calienta. El líquido más volátil se evaporará primero, luego se condensará y se recogerá como líquido.
El tercer método es la filtración, que se utiliza para separar un sólido (no disuelto) de un líquido.
 Montaje de filtración. Wikimedia commons.
Montaje de filtración. Wikimedia commons.
Se coloca un papel de filtro dentro de un embudo sobre un matraz. El sólido quedará atrapado por el papel de filtro, y el líquido pasará a través de él al matraz.
Por último, tenemos la separación mediante un embudo de separación. Este método utiliza las diferentes densidades de los líquidos de una mezcla.
 Un embudo de separación. Wikimedia commons
Un embudo de separación. Wikimedia commons
Se vierte la mezcla líquida en el embudo. El embudo (cerrado) se agita y se invierte hasta que los líquidos se hayan separado en fases, como verás arriba. Se gira la llave de paso (manivela) para abrir el embudo y dejar salir la fase inferior
Composición de las mezclas: Ejemplos
Al observar una mezcla, es frecuente querer conocer su composición. Esto es especialmente importante en la industria farmacéutica, porque siempre queremos saber el porcentaje de un fármaco dentro de una pastilla.
Al calcular la composición, utilizamos la composición porcentual.
La composiciónporcentual es el porcentaje de un elemento o compuesto dentro de una sustancia.
Veamos un ejemplo de cómo determinar la composición de una sustancia dada en una mezcla.
Normalmente tomas un café que contiene 95 mg de cafeína, pero te han regalado una bolsa de café sin etiquetar. Tu amigo te dice que tiene menos cafeína que tu taza habitual. Una ración son 12 g por taza, lo que supone un 0,12% de nitrógeno (N). La masa molar de la cafeína (C8H10N4O2) es 194,2 g/mol y la masa atómica del nitrógeno es 14,01 g/mol. ¿Está en lo cierto tu amigo?
Así que nuestro objetivo aquí es ver si el contenido de cafeína es menor en el café sin etiquetar que en el café que bebes normalmente. Vamos a suponer que la única fuente de nitrógeno en el café es la cafeína. Empezaremos multiplicando el porcentaje de nitrógeno por la masa total para obtener la masa de nitrógeno.
\(0.12\%*12\,g=0.0144\,g\,N\)
Ahora convertimos de gramos de nitrógeno a gramos de cafeína. Primero tenemos que hallar los moles de nitrógeno, para poder convertirlos en moles de cafeína.
\(\frac{0.0144\,g}{\frac{14.01\,g}{mol}}=0.0010\,mol\,N\)
Vemos en la fórmula química que hay 4 moles de nitrógeno en la cafeína (C8H10N4O2), así que tenemos que dividir el número de moles de nitrógeno entre 4 para obtener los moles de cafeína.
\(0.0010\,mol\,N*\frac{1\,mol\,C_8H_{10}N_4O_2}{4\,mol\,N}=0.00025\,mol\,\text{caffeine}\)
Por último, multiplicamos la cantidad molar por la cantidad molar para obtener la concentración de cafeína
\(0.00025\,mol*\frac{194.2\,g}{mol}=0.04855\,g\)
\(0.04855\,g*\frac{1000\,mg}{1\,g}=48.55\,mg\,\text{caffeine}\)
Así que tu amigo tiene razón en que hay menos cafeína, ya que 48,55<95.
Hagamos otro ejemplo:
En un recipiente hay una mezcla gaseosa de amoníaco (NH3) y dióxido de carbono (CO2). La composición porcentual del dióxido de carbono es del 35%. ¿Cuál es la masa de nitrógeno si la masa total de la mezcla es 76 g? (La masa molar del amoníaco es 17,03 g/mol y la masa molar del nitrógeno es 14,01 g/mol).
Nuestro primer paso es calcular la composición porcentual del amoníaco, ya que es la única especie que contiene nitrógeno.
\(100\%-35\%=65\%\,NH_3\)
A continuación, multiplicamos la cantidad de masa total por la composición porcentual del amoníaco para obtener su masa.
\(65\%*76\,g=49.4\,g\,NH_3\)
Ahora dividimos por la masa molar para obtener la cantidad molar de amoníaco. Como hay un mol(NH3) de nitrógeno en el amoníaco, las cantidades molares serán iguales.
\(\frac{49.4\,g}{\frac{17.03\,g}{mol}}=2.90\,mol\,NH_3=2.90\,mol\,N\)
Por último, multiplicamos los moles de nitrógeno por su masa molar para obtener la masa de nitrógeno de la mezcla.
\(2.90\,mol*\frac{14.01\,g}{mol}=40.6\,g\,N\)
Mezclas de gases y presión parcial
Aunque en el ejemplo anterior hemos calculado la composición de una mezcla gaseosa, normalmente medirías los gases por su presión o cantidad molar. En lugar de utilizar la composición porcentual, utilizamos la fracción molar.
La fracción molar (χ) es la relación entre los moles de una especie y los moles totales de una mezcla. La fórmula es: $$\chi_A=\frac{n_A}{n_{tot}},\text{donde n es el número de moles y}{,n_{tot},\text{es la suma de los moles de cada especie}$$.
La presiónparcial es la fracción de la presión total causada por un componente.
Así es como relacionamos estas dos variables, PV = nRT, utilizando la ley de los gases ideales:
$$\frac{P_{A}}{P_{tot}}=\frac{\frac{n_{A}R}{T}}{\frac{n_{tot}R}{T}}=\frac{n_A}{n_{tot}}=\chi_A$$ Rearranging this we get: $$P_A=\chi_AP_{tot}$$ Ahora que tenemos nuestras fórmulas vamos a trabajar en un problema.
Un recipiente de 2,5 L a 365 K contiene una mezcla de 0,52 mol de gas que es 0,17 mol de metano (CH4) y 0,35 mol de etano (C2H6). ¿Cuál es la presión parcial del metano y del etano en atm?
En primer lugar, tenemos que calcular la presión total utilizando la ecuación de los gases ideales. La constante de los gases ideales (R) tiene varios valores según las unidades. Como tenemos unidades de L, K y atm, utilizaremos la constante R=0,0821 Latm/molK.
\(P_{tot}V=n_{tot}RT\)
\(P_{tot}V=(0.52\,mol)(0.0821\frac{Latm}{molK})(365\,K)\)
\(P_{tot}(2.5\,L)=15.58\,Latm\)
\(P_{tot}=6.23\,atm\)
A continuación, tenemos que calcular χ tanto para el metano como para el etano
\(\chi_{CH_4}=\frac{n_{CH_4}}{n_{tot}}\)
\(\chi_{CH_4}=\frac{0.17\,mol}{0.52\,mol}\)
\(CH_4)=0,33
\(0.33+\chi_{C_2H_6}=1.00\)
\(\chi_{C_2H_6}=0.67\)
Por último, podemos calcular la presión parcial de cada compuesto
\(P_{CH_4}=P_{tot}\chi_{CH_4}\)
\(P_{CH_4}=6.23\,atm*0.33\)
\(P_{CH_4}=2.06\,atm\)
\(P_{C_2H_6}=P_{tot}\chi_{C_2H_6}\)
\(P_{C_2H_6}=6.23\,atm*0.67\)
\(P_{C_2H_6}=4.17\,atm\)
También puedes restar la presión parcial del metano de la presión total para obtener la presión parcial del etano.
Composición de la mezcla - Puntos clave
- Una mezcla es una combinación de dos o más sustancias en cualquier proporción. Las sustancias de una mezcla conservan sus propiedades originales y no sufren una reacción química para mezclarse
- Las mezclashomogéneas son un tipo de mezcla en el que la composición es uniforme, mientras que las mezclas heterogéneas son mezclas en las que la composición no es uniforme.
- Una fase es cualquier parte de una muestra que sea uniforme.
- Hay 4 formas habituales que utilizan los químicos para separar mezclas:
- Evaporación
- Destilación
- Filtración
- Separación mediante un embudo de separación
- Lacomposición porcentual es el porcentaje de un elemento o compuesto dentro de una sustancia.
- La fracción molar (χ) es la relación entre los moles de una especie y los moles totales de una mezcla. La fórmula es: $$\chi_A=\frac{n_A}{n_{tot}},\text{donde n es el número de moles y}{,n_{tot},\text{es la suma de los moles de cada especie}$$.
- Lapresión parcial es la fracción de la presión total de una mezcla resultante de una especie.











