Definición de efecto iónico común
Empecemos por la definición del principio de Le Chatelier y por la definición de efecto iónico común.
El principio de Le Chatelier afirma que cuando un sistema químico en equilibrio sufre un cambio repentino de concentración, volumen, temperatura y/o presión que le hace alejarse del equilibrio, este cambio es, a su vez, contrarrestado por el sistema de forma que se restablece el equilibrio.
El principio de Le Chatelier y el efecto del ion común están directamente relacionados. Para comprender el efecto del ion común, primero debemos comprender el principio de Le Chatelier. Más arriba hemos escrito la importancia básica y la definición del principio de Le Chatelier por esta misma razón.
Para facilitar aún más la comprensión de este artículo, repasaremos a continuación los fundamentos de Le Chatelier:
Perturbación significa en este caso un cambio en las condiciones del sistema. Que incluyen
cambio detemperatura por enfriamiento o calentamiento
cambio en laconcentración añadiendo o eliminando un reactivo/producto
cambio en lapresión añadiendo un gas o disminuyendo el volumen de una reacción
El equilibrio químico al que nos referimos es la reacción neta global. Cuando una reacción está en equilibrio, la velocidad de reacción de los reactantes y los productos son equivalentes.
Si una reacción no está en equilibrio, Le Chatelier afirma que la reacción volverá al equilibrio ajustando las concentraciones de reactantes o productos para restablecer la relación de equilibrio.
- Cuando aumentamos la concentración de los reactivos, el equilibrio se desplaza hacia la derecha y se favorece la reacción de avance, por lo que se fabrica más producto hasta que se alcanza de nuevo el equilibrio.
- Cuando aumentamos la concentración de los productos, el equilibrio se desplaza hacia la izquierda y se favorece la reacción hacia atrás, con lo que se fabrican más reactantes hasta que se alcanza de nuevo el equilibrio.
Esto es sólo un resumen rápido del principio de Le Chatelier, para una comprensión más profunda consulta nuestro artículo "El principio de Le Chatelier".
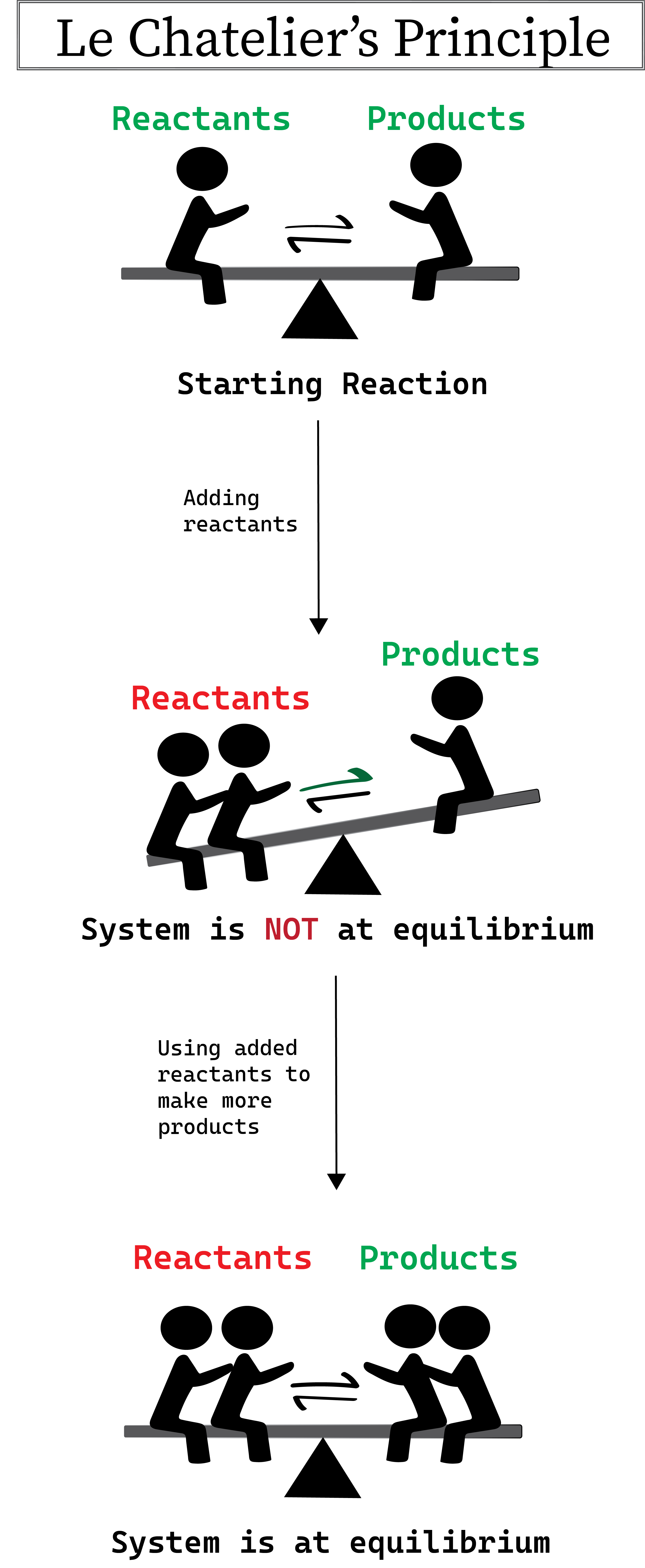
Figura 1: Ilustración del principio de Le Chatelier. Daniela Lin, Estudiar originales más inteligentes.
En la ilustración anterior, el aumento de reactantes provoca un desplazamiento del equilibrio hacia el otro lado hasta que se restablezca el equilibrio mediante la producción de más productos. Ten en cuenta que si añadiéramos más productos en lugar de reactantes, el equilibrio se desplazaría hacia los productos hasta que se fabricaran más reactantes para restablecer el equilibrio.
Ahora que hemos visto brevemente el principio de Le Chatelier, podemos pasar a definir nuestro efecto iónico común.
El efecto iónico común es un desplazamiento del equilibrio provocado por la adición de un ion que ya interviene en la reacción.
Efecto del ion común sobre la solubilidad
Puesto que hemos definido el efecto del ion común como un desplazamiento del equilibrio, la siguiente pregunta sería ¿cómo afecta este desplazamiento del equilibrio a nuestra reacción?
La respuesta sencilla sería que el desplazamiento del equilibrio causado por la adición de un ion común afecta a la solubilidad.
Esto se debe a que cuando añadimos un ion común, la reacción se desplaza hacia los reactantes (izquierda) para equilibrar el exceso de producto, lo que provoca más precipitación para una solución saturada.
 Figura 2: Ilustración del efecto iónico común. Daniela Lin, Study Smarter Originals.
Figura 2: Ilustración del efecto iónico común. Daniela Lin, Study Smarter Originals.
En el gráfico anterior, la solubilidad del KCl en agua es mayor que su solubilidad en una solución acuosa de NaCl, ya que el KCl y el NaCl contienen iones comunes (Cl).
Efecto de los iones comunes en la solubilidad de las sales iónicas
Tras varios experimentos con sales iónicas, los científicos han obtenido patrones en los datos que han acuñado como reglas de solubilidad.
Es importante que conozcamos estas tendencias generales para, más adelante, calcular la solubilidad molar de los iones comunes.
Lasolubilidad molar es el número de moles de un soluto que pueden disolverse en un litro de solución hasta que ésta se sature.
Para una temperatura dada, una solución saturada tiene la cantidad máxima de soluto disuelto en ella antes de que se produzca la precipitación.
La precip itación se produce en una disolución cuando se forma un sólido o precipita fuera de la disolución.
 Figura 3: Tabla de solubilidad de distintas sales. El asterisco rojo indica las excepciones, que se muestran en la imagen inferior. Daniela Lin, Study Smarter Originals.
Figura 3: Tabla de solubilidad de distintas sales. El asterisco rojo indica las excepciones, que se muestran en la imagen inferior. Daniela Lin, Study Smarter Originals.
 Figura 4: Se muestran las excepciones de solubilidad de las sales iónicas. Daniela Lin, Study Smarter Originals.
Figura 4: Se muestran las excepciones de solubilidad de las sales iónicas. Daniela Lin, Study Smarter Originals.
En concreto, cuando un exceso de una sal ligeramente soluble se disuelve en agua, se crea un equilibrio entre la sal sólida y los iones de la sal en la solución saturada. Otro dato importante sobre la solubilidad es el Ksp.
\(K_{sp}\), constante del producto de solubilidad, es la constante de equilibrio para el equilibrio de solubilidad de una sal ligeramente soluble.
Un soluto es una sustancia que se disuelve en un disolvente.
Un
disolvente es una sustancia en la que se disuelve el soluto, dando lugar a una solución.
A una temperatura dada, la constante del producto de solubilidad, \ (K_{sp}\), mantiene un valor numérico constante aunque varíe la concentración de la sal. Por tanto, cuanto mayor sea\( K_{sp}\) más soluble será el compuesto. No es necesario memorizar las tablas de solubilidad anteriores. En lugar de eso, familiarízate con ellas y comprende que las que forman sales insolubles tendrán \( K_{sp}\ ) menores y viceversa para las sales más solubles.
Esto también implica que la adición de una sal que tenga un ion común con una sal ligeramente soluble dada (soluto) conduciría a una solubilidad del soluto menor y a la formación del precipitado antes de lo que predice la constante del producto de solubilidad, \(K_{sp}\), para la sal pura ligeramente soluble en agua (disolvente) sola. Recuerda que la \(K_{sp}\), se calcula para un soluto disuelto en un disolvente puro.
Solubilidad molar y efecto del ion común
Hablemos ahora de la solubilidad molar y del efecto del ion común.
Antes hemos mencionado que la solubilidad molar es la cantidad máxima de un soluto que puede disolverse en un disolvente puro antes de que la solución se sature.
La saturación de la solución se produce cuando el soluto añadido forma un precipitado.
Un precipitado es la cantidad de sustancia añadida que no forma una solución.
Hemos observado que, una vez que la solución se satura, el soluto deja de disolverse. Como ya hemos dicho, solemos utilizar la \ (K_{sp}\), la constante de solubilidad del producto , para describir la disolución de una sal poco soluble en una solución acuosa. Además, los sólidos no suelen incluirse porque su cambio de concentración no afecta a la \(K_{sp}\), ya que no se disuelven.
En cambio, la solubilidad molar describe la disolución de una sustancia en un litro de disolución. La unidad de la solubilidad molar es mol/L o M.
Esto significa que la constante de solubilidad del producto no es lo mismo que la solubilidad molar.
Considera la ecuación:
$$X_2Y\left(s \right) \rightarrow X^+\left(aq \right)+Y^-\left(aq \right)$$
donde, X2Y (s), representa una sal de interés, el catión de la sal es, X+, y el anión de la sal es, Y-. Digamos que la concentración final del catión es[X +] = 0,5 M, entonces la concentración del anión sería[Y -] = 0,25 M (porque en esta sal X2Y hay 2 moles de X + por cada mol de Y - ). Por tanto, la constante de solubilidad del producto vendría dada por:
$$K_{sp}=izquierda[X^+ \derecha]^2izquierda[Y^- \derecha]=izquierda[0,5 \derecha]^2izquierda[0,25 \derecha]=0,0625$$
Mientras que la solubilidad molar de la sal hipotética, X2Y, que añadimos a la solución habría sido, simplemente,[X2Y] = 0,25 M.
Ejemplos comunes de efecto iónico
Ahora que hemos leído qué es \ (K_{sp}\), cómo afecta el efecto iónico común a la solubilidad de las sales iónicas y algunas reglas generales de solubilidad, podemos pasar a estudiar algunos ejemplos de efecto iónico común.
¿Cuál es la concentración del ion o iones comunes en la siguiente disolución?
Una solución que contiene 0,25 M de cada una de las sales siguientes: KCl, NaCl y AgCl.
1. En primer lugar, tenemos que identificar el ion común en esta situación, que es [Cl-].
2.Esto significa que [Cl-] = 0,25 M × 3 = 0,75 M, debido a que las tres sales KCl, NaCl, AgCl contienen el ion común, [Cl-].
Respuesta: Por tanto, la concentración del ion común, [Cl-], es 0,75 M.
Ten en cuenta que si tuviéramos algo como Cloruro de Magnesio, MgCl2, habría aportado 0,25 M × 2 = 0,5 M, por sí solo, ya que contiene 2 Cloruros.
Dada la siguiente reacción del oxalato cálcico disuelto en agua:
\(CaC_2O_4 (s) Ca^{2+} (aq) + C_2O_4^{2-} (aq) (aq) \)
En general, ¿qué crees que le ocurriría al oxalato cálcico \((CaC_2O_4)\) cuando añadimos cloruro cálcico y por qué?
Cuando el cloruro cálcico se disuelve en agua obtenemos
\(CaCl_2 (s) \rightleftharpoons Ca^{2+} (aq) + 2Cl^{-} (aq) \ (aq) \)
Según el efecto del ion común y el principio de Le Chatelier, la adición de \( CaCl_2\) a la reacción dada introduce más \(Ca^{2+} (aq) \
) en la solución debido a que comparten un ion común o \
(Ca^{2+} (aq) \) .Añadir más \(Ca^{2+} (aq) \) significa:
\(CaC_2O_4 (s) \ flecha izquierda Ca^{2+} (aq) + C_2O_4^{2-} (aq) \) . (aq) \)
Le Chatelier impulsa la reacción hacia los reactantes (izquierda), mientras que el efecto del ion común nos dice que hay una menor solubilidad del oxalato cálcico \ ((CaC_2O_4)\) en la solución en la que interviene el cloruro cálcico \ ( (CaCl_2)\).
El ion común, en este caso, es el ion calcio. Según el efecto del ion común, la solubilidad del oxalato cálcico, CaC2O4, disminuye a medida que precipita, lo que provoca la alteración del equilibrio. Como tal, Le Chatelier impulsará la reacción hacia los reactantes hasta que se restablezca el equilibrio.
¿Cuál es la solubilidad molar de una disolución de oxalato cálcico, \(CaC_2O_4\), después de añadirle cloruro cálcico , \( (CaCl_2)\), a la misma?
Observamos que para el oxalato cálcico la constante de solubilidad del producto es
\(CaC_2O_4 (s) \rightleftharpoons Ca^{2+} (aq) + C_2O_4^{2-} (aq) \ (aq)
\(K_{sp}) = (2,30 veces 10^{-9})
Supongamos que añadimos oxalato cálcico a una solución 0,15 M de cloruro cálcico.
Para responder a esta pregunta tendríamos que construir un gráfico ICE o de Inicial, Cambio y Equilibrio:
 Figura 5: Diagrama ICE de oxalato cálcico con cloruro cálcico. Daniela Lin, Study Smarter Originals.
Figura 5: Diagrama ICE de oxalato cálcico con cloruro cálcico. Daniela Lin, Study Smarter Originals.
El gráfico ICE puede explicarse como sigue:
- Inicial, procede de la concentración inicial del catión calcio, Ca2+, que procede del cloruro cálcico, CaCl2. Recuerda que empezamos con una solución de 0,15 M CaCl2.
- El cambio procede de los iones disueltos \( Ca^{2+} \) y \(C_2O_4^{2-} \) (o x) obtenidos al añadir \ (CaC_2O_4\) a la solución 0, 15 M \( (CaCl_2)\).
- El equilibrio, resulta de sumar las líneas Inicial y Cambio.
Por último, establecemos la ecuación \( K_{sp}\ ):
\(K_{sp}\) = \ ([Ca^{2+}] \) \([C_2O_4^{2-}] \)
\(2,30 veces 10^{-9}) = (0,15 + x) (x)
Se trata de una ecuación cuadrática que suele ser inconveniente resolver directamente. Sin embargo, debido a que el oxalato cálcico no es muy soluble, puedes considerar x como despreciable (un número muy pequeño) y utilizar la aproximación
\(2,30\times10^{-9}\) = (0,15) (x)
Resolviendo para x obtenemos alrededor de \ (1,50 veces10^{-8}\) M para la solubilidad molar del oxalato cálcico, CaC2O4, en una solución de 0,15 M de cloruro cálcico, CaCl.
¿Y la solubilidad molar del oxalato de calcio, CaC2O4, en agua pura?
Para responder a esta pregunta también necesitamos construir un gráfico ICE o de Inicial, Cambio y Equilibrio:
 Figura 6: Gráfico ICE sólo para el oxalato cálcico. Daniela Lin, Study Smarter Originals.
Figura 6: Gráfico ICE sólo para el oxalato cálcico. Daniela Lin, Study Smarter Originals.
El gráfico ICE puede explicarse como sigue:
- Inicial, procede de las concentraciones iniciales de cada ion. Para \ ( Ca^{2+} \) es 0 M, ya que empezamos con agua pura.
- Cambio, proviene de los iones disueltos \( Ca^{2+} \) y \(C_2O_4^{2-} \) (o x) obtenidos al añadir, \( CaC_2O_4\), al agua pura.
- El equilibrio resulta de sumar las líneas Inicial y Cambio.
Por último, establece la ecuación \(K{sp}\):
\(K_{sp}\) = \ ([Ca^{2+}] \) \ ([C_2O_4^{2-}] \)
\(2,30 veces 10^{-9}) = (x) (x)
Resolviendo para x obtenemos alrededor de \(4,80\times10^{-5}\) M para la solubilidad molar del cloruro cálcico, CaC2O4, en agua pura.
Comparando los dos ejemplos, vemos que con la adición de un ion común \ ( Ca^{2+} \) la solubilidad molar del oxalato cálcico, CaC2O4, disminuye a medida que se promueve la precipitación. Éste es el efecto del ion común en acción.
Has llegado al final de este artículo. Hemos repasado los fundamentos del principio de Le Chatelier y lo hemos relacionado con el efecto iónico común. Además, hemos aprendido sobre la solubilidad molar de los iones, las reglas de solubilidad y hemos repasado algunos ejemplos para promover una mayor comprensión.
Para ver más ejercicios, ve a las fichas.
Efecto iónico común - Puntos clave
El principio de Le Chatelier trata de la perturbación del equilibrio de una reacción química.
La perturbación implica un cambio en las condiciones del sistema, como un cambio en la presión, la temperatura y la concentración.
El efecto del ion común es una alteración del equilibrio provocada por la adición de un ion que ya interviene en la reacción.
Cuando añadimos un ion común, la reacción se desplaza hacia los reactantes (izquierda) para equilibrar el exceso de producto, lo que provoca más precipitación. Esto significa que el efecto del ion común DISMINUYE la solubilidad de los iones.
Referencias
- Harwood, William S., F. G. Herring, Jeffry D. Madura y Ralph H. Petrucci. Principios de Química General y Aplicaciones Modernas. 9ª ed. Nueva Jersey: Prentice Hall, 2007.
- Libretextos. (2022, 8 de mayo). Efecto iónico común. LibreTextos de Química.
- Solubilidad y equilibrio ión-complejo. Solubilidad. (s.f.).













