Definición de equilibrio dinámico
Algunas reacciones son reversibles. Los reactivos reaccionan para formar los productos, como cabría esperar, y esto se denomina reacción directa. Sin embargo, los productos también reaccionan para formar los reactantes, y esto se conoce como reacción hacia atrás. Si dejas solas a las especies implicadas en una reacción reversible en un sistema cerrado durante cierto tiempo, acabarán alcanzando un punto de estabilidad. Esto se conoce como equilibrio dinámico.
Un equilibrio dinámico es el estado de una reacción reversible en el que la velocidad de la reacción hacia delante es igual a la velocidad de la reacción hacia atrás y las concentraciones de reactantes y productos siguen siendo las mismas.
Veámoslo más detenidamente. Considera la siguiente reacción
\[A + B \leftrightharpoons C\]
En la reacción hacia delante, los reactantes (A y B) reaccionan para formar el producto (C). En la reacción hacia atrás, el producto (C) reacciona para formar los reactantes (A y B).
Si mezclas A y B en un recipiente hermético, reaccionan rápidamente para formar C. La velocidad de la reacción hacia delante es inicialmente muy alta, y gran cantidad de A y B se convierten en C. Esto hace que las concentraciones de A y B disminuyan mientras que la concentración de C aumenta. Sin embargo, a medida que aumenta la concentración de C, empieza a producirse la reacción hacia atrás: C se convierte de nuevo en A y B. Esto hace que la concentración de C disminuya mientras que las concentraciones de A y B aumentan.
Puedes ver que se producen dos reacciones al mismo tiempo: A y B se transforman en C, y C se transforma de nuevo en A y B. Los ritmos de estas dos reacciones son inicialmente muy diferentes, pero con el tiempo se igualan. Ambas reacciones siguen en curso, pero simplemente se producen al mismo ritmo. Esto significa que, en conjunto, las concentraciones de A, B y C permanecen constantes. A este punto lo llamamos equilibrio dinámico.
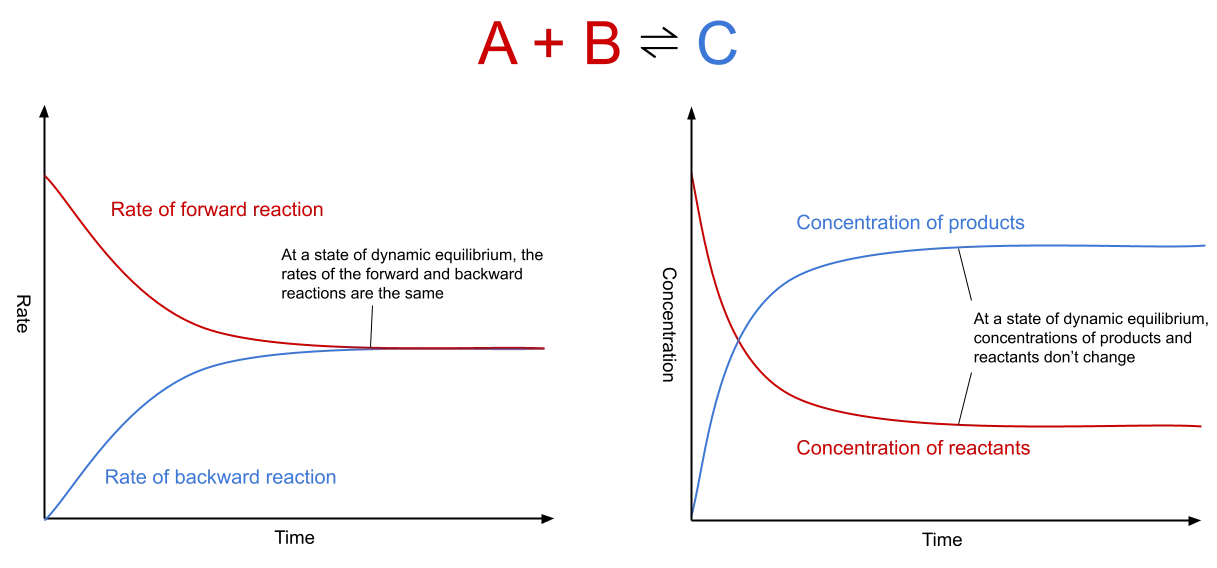
Fig. 1: Gráficos que muestran la velocidad de reacción y la concentración en el equilibrio dinámico. El primer gráfico muestra que en el equilibrio dinámico, la velocidad de las reacciones hacia delante y hacia atrás no cambia y es la misma para ambas. El segundo gráfico muestra que en el equilibrio dinámico, la concentración del producto y de los reactantes, aunque diferentes entre sí, permanecen estables a lo largo del tiempo.
Podemos aplicar esto a nuestra analogía de la tienda de comestibles. Cuando se abre la tienda, al principio hay mucha gente fuera y ninguna dentro. La gente se precipita dentro cuando se abren las puertas, lo que representa una velocidad elevada de la reacción hacia delante. El número de personas dentro de la tienda aumenta, mientras que el número de personas fuera de la tienda disminuye.
Al cabo de un tiempo, la gente empieza a marcharse. Ya han comprado y ahora sólo quieren irse a casa. Esto representa la reacción hacia atrás. Finalmente, el número de personas que salen de la tienda es igual al número de personas que entran en ella. En este punto, las velocidades de las reacciones hacia delante y hacia atrás son iguales y las concentraciones de personas dentro y fuera de la tienda siguen siendo las mismas. Hemos alcanzado un estado de equilibrio dinámico.
Es importante señalar que se puede alcanzar un equilibrio dinámico desde cualquier dirección. No importa si empiezas sólo con los reactantes o sólo con los productos, o quizá con una mezcla de ambos: dale al sistema el tiempo suficiente y acabarás alcanzando un equilibrio dinámico.
Propiedades del equilibrio dinámico
En resumen, un equilibrio dinámico se caracteriza por dos propiedades principales:
- La velocidad de la reacción hacia delante y la velocidad de la reacción hacia atrás son iguales.
- Las concentraciones de reactivos y productos no cambian.
Equilibrio dinámico frente a equilibrio estático
Hemos aprendido que en un equilibrio dinámico, las velocidades de las reacciones hacia delante y hacia atrás son las mismas y las concentraciones de productos y reactivos permanecen invariables. Sin embargo, ambas reacciones siguen en curso, de ahí el uso de la palabra dinámico. Podemos decir que a nivel microscópico, el sistema cambia, pero a escala macroscópica, el sistema permanece inalterado. Esto es similar a un número igual de compradores que entran y salen del supermercado al mismo tiempo.
Losequilibrios estáticos son un poco diferentes. En el equilibrio estático, las concentraciones de productos y reactivos siguen sin cambiar, pero esto se debe a que no se producen reacciones químicas: no tienen lugar ni la reacción hacia delante ni la reacción hacia atrás. Tanto a nivel microscópico como macroscópico, el sistema permanece inalterado. Esto es análogo a la tienda de comestibles una vez finalizado el horario de apertura. El número de personas dentro y fuera de la tienda sigue siendo el mismo, pero esto se debe a que nadie entra ni sale. Podemos decir que no se produce ni la reacción hacia delante ni la reacción hacia atrás.
Esta tabla resume las diferencias entre los equilibrios dinámico y estático:
| Tipo de equilibrio | Dinámico | Estático |
| Concentraciones de las especies | Permanecen iguales | Permanecen iguales |
| Velocidad de reacción | La velocidad de la reacción hacia delante es igual a la velocidad de la reacción hacia atrásAmbas reacciones se producen | No se produce ninguna de las dos reacciones |
| Sistema | Cerrado | Abierto o cerrado |
Ejemplo de equilibrio dinámico
Veamos ahora algunos ejemplos de equilibrios dinámicos.
Si colocas cristales de yodo gris-negro en un vaso de precipitados y añades una tapa, al final se forma un equilibrio dinámico. Los cristales de yodo sólido se descomponen en vapor de yodo púrpura, mientras que, al mismo tiempo, el yodo púrpura gaseoso se solidifica en cristales de yodo gris-negro.
 Fig. 2: El yodo, un ejemplo de equilibrio dinámico.
Fig. 2: El yodo, un ejemplo de equilibrio dinámico.
Otro ejemplo de equilibrio dinámico es el proceso Haber, utilizado en la producción industrial de fertilizantes. En él, las moléculas de nitrógeno e hidrógeno reaccionan para formar amoníaco en una reacción reversible. Ésta es la ecuación
\[N_2 (g) + 3H_2 (g) \leftrightharpoons 2NH_3(g)\[N_2 (g) + 3H_2 (g) \leftrightharpoons 2NH_3(g)\].
Dinámica de no equilibrio
La dinámica de noequilibrio es una rama de la termodinámica que se utiliza para modelizar sistemas que no siguen las condiciones de equilibrio. Se basa en variables de equilibrio para predecir el comportamiento de sistemas que no se encuentran en equilibrio dinámico y tiene muchas aplicaciones en el mundo real. Entre ellas está la modelización de los sistemas de transporte y la composición de los ecosistemas.
Este es el final de este artículo. A estas alturas deberías ser capaz de explicar qué entendemos por equilibrio dinámico y dar sus propiedades características. También deberías poder comparar los equilibrios dinámico y estático y dar ejemplos de equilibrio dinámico.
Equilibrio dinámico - Puntos clave
- Un equilibrio dinámico es el estado de una reacción reversible en el que la velocidad de la reacción hacia delante es igual a la velocidad de la reacción hacia atrás y las concentraciones de reactivos y productos permanecen iguales.
- Los equilibrios dinámicos sólo se dan en un sistema cerrado.
- En el equilibrio dinámico, tanto la reacción hacia delante como la reacción hacia atrás están en curso. En cambio, en el equilibrio estático no se produce ninguna de las dos reacciones.
- Ejemplos de equilibrios dinámicos son muchas reacciones industriales reversibles, como el proceso Haber.









