- En este artículo hablaremos de los fullerenos.
- En primer lugar, analizaremos el buckminsterfullereno.
- Luego, para terminar, hablaremos de los nanotubos de carbono, sus propiedades y usos.
Los alótropos son diferentes formas estructurales en las que puede existir el mismo elemento.
Los fullerenos, el grafito y el diamante son alótropos del carbono porque todos están formados por átomos de carbono. La diferencia está en la estructura molecular, es decir, la disposición de los átomos que forman la estructura repetitiva básica de toda la molécula.
Las grandes moléculas de Fullereno suelen estar compuestas por anillos de 6 carbonos, pero a veces también tienen anillos de 5 o 7 carbonos. Los átomos de carbono de los fullerenos pueden estar unidos por enlaces covalentes simples o dobles. Los fullerenos se fabrican sintéticamente y no se encuentran en la naturaleza. Hay muchas moléculas de fullereno que se pueden sintetizar. La molécula de fullereno más pequeña está formada por 20 átomos de carbono, mientras que la más grande puede tener ¡720 átomos de carbono! Veamos algunas moléculas comunes de Fullereno.
Los fullerenos pueden encontrarse en el polvo interestelar o en los meteoritos, pero no en la atmósfera terrestre.
La estructura del fullereno
El C60 es una molécula de fullereno formada por 60 átomos de carbono. Los átomos están dispuestos en anillos hexagonales y pentagonales. Hay 20 anillos hexagonales y 12 anillos pentagonales, que juntos forman una estructura esférica. Observa la figura para visualizar la forma de la molécula de Buckminsterfullereno.
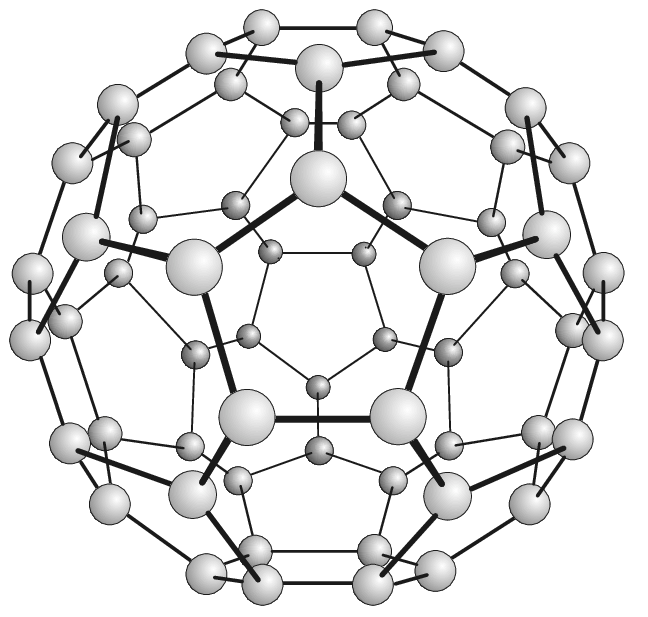
Fig. 1: Buckminsterfullereno (C60) |
ResearchGate En la figura, deberías poder ver 6 anillos hexagonales rodeando un anillo pentagonal? El Buckminsterfullereno también se llama Buckyball (más fácil de recordar, ¿verdad?). El Buckminsterfullereno C60 es la molécula de fullereno más pequeña en la que no hay 2 anillos pentagonales que se toquen entre sí.
La estructura del C60 Buckminsterfullereno se denominaicosaedro truncado. Esta forma de la estructura se parece a un balón de fútbol, y está formada por 20 hexágonos regulares y 12 pentágonos regulares. Cada vértice de cada polígono tiene un átomo de Carbono; y cada arista de cada polígono es un enlace entre los átomos de Carbono.
El Buckminsterfullereno fue el primer fullereno descubierto en 1985 por Robert Curl, Harold Kroto y Richard Smalley. Recibieron el premio Nobel de Química en 1996 por el descubrimiento de los fullerenos.
En las moléculas de fullereno, cada átomo de carbono forma 3 enlaces covalentes. Los átomos de carbono comparten enlaces covalentes simples y dobles. Los enlaces dobles se llaman enlaces pi (π), y los electrones compartidos en un enlace π se llaman electrones π. Estos electrones π forman una nube de electrones alrededor de toda la estructura de la molécula Buckyball. La molécula ocupa esencialmente el espacio que puede albergar esta nube de electrones π.
El diámetro de la molécula de C60 , incluida esta nube de electrones π, es de 1,0 nm. También se denomina diámetro de Van Der Waals del fullereno.
 Fig. 2: Diámetro del fullereno de Buckminster | ScienceDirect
Fig. 2: Diámetro del fullereno de Buckminster | ScienceDirect
El diámetro de la molécula de C60 medido de núcleo a núcleo (excluyendo la región de electrones π) es de 0,7 nm.
Hay muchas moléculas posibles de fullereno, pero el más común es el Buckminsterfullereno (C60). Otro fullereno común es el fullereno C70, formado por 70 átomos de carbono.
Hay fullerenos de muchos más tamaños. El fullereno más pequeño sólo tiene 20 átomos de carbono. Está formado por anillos pentagonales de átomos de carbono. Algunos fullerenos tienen hasta 720 átomos de carbono: el fullereno C720.
Propiedades del fullereno
Su forma molecular única y la presencia de la región de electrones π les confieren estas propiedades:
- El buckminsterfullereno puede participar en varios tipos de reacciones químicas. Esto se debe a su capacidad de donar y aceptar electrones.
- Puedereaccionar químicamente con otras especies manteniendo intacta su estructura esférica.
- Puede resistir altas temperaturas y presiones sin cambiar químicamente.
- Insoluble en agua.
- Temperatura de sublimación de 600oC. Esto significa que a 600oC, pasa de su estado sólido a su estado gaseoso directamente, sin cambiar al estado líquido.
Dos propiedades importantes del fullereno son su punto de fusión y su diámetro.
Punto de fusión del fullereno
El punto de fusión del fullereno es de 280ºC.
Diámetro del fullereno
El diámetro del fullereno es de aproximadamente 1,1 nm.
Usos del fullereno
Dadas sus propiedades, el fullereno de Buckminster tiene una amplia gama de aplicaciones
- Puede utilizarse en baterías, ya que tiene la capacidad tanto de ganar como de perder electrones.
- Además de en las pilas, también encuentra aplicaciones en algunos dispositivos electrónicos avanzados.
- Los derivados del C60 con metales alcalinos y alcalinotérreos encuentran aplicaciones en materiales superconductores.
- Puede utilizarse para reducir la contaminación causada por los combustibles fósiles - encuentra aplicación en la industria del automóvil.
- Pueden utilizarse para mejorar las propiedades de los materiales de recubrimiento, como las pinturas.
- Buenoslubricantes por su estructura molecular esférica.
- Buenosoxidantes. Los derivados del buckminsterfullereno se utilizan en cosmética.
Nanotubos de carbono
A diferencia del buckminsterfullereno, los nanotubos de carbono son moléculas cilíndricas de fullereno. Su estructura básica es un anillo de 6 carbonos.
 Fig. 3: Nanotubo de carbono | Phys.org
Fig. 3: Nanotubo de carbono | Phys.org
Al igual que el buckminsterfullereno, el Carbono forma 3 enlaces covalentes en los Nanotubos. Esto significa que hay una región de electrones π alrededor de su forma cilíndrica. El diámetro de los nanotubos de carbono suele ser de unos pocos nanómetros. Sin embargo, pueden variar desde unos pocos micrómetros hasta unos pocos milímetros de longitud. Los nanotubos son los fullerenos descubiertos más recientemente y desde entonces han encontrado muchas aplicaciones.
Nanotubos de carbono: Propiedades y usos
Los nanotubos de carbono tienen las siguientes propiedades
- Excelente resistencia a la tracción.
- Excelenteconductividad térmica - ¡incluso mejor que el diamante!
- Excelenteconductividad eléctrica - varias veces mejor que incluso algunos metales como el Cobre.
Estas propiedades permiten variadas aplicaciones de los nanotubos de carbono, como por ejemplo
- Utilización como material de refuerzo (por ejemplo, en raquetas de tenis).
- Modificación de materiales compuestos. Puede utilizarse para hacer que los materiales sean más resistentes y duraderos. También puede utilizarse para hacer que los materiales sean mejores conductores térmicos.
- Puede utilizarse para fabricar componentes eléctricos.
- Puede utilizarse en materiales de construcción.
- Puede utilizarse en la industria del refinado del petróleo.
- Industria energética - Puede utilizarse en baterías de iones de litio (¡las baterías de los teléfonos móviles y los ordenadores portátiles!), células solares y pilas de combustible.
- Plásticos - termoplásticos y termoestables.
- Pueden utilizarse en nanotecnología.
- Su gran resistencia a la tracción los convierte en un posible uso en ascensores espaciales en un futuro lejano.
Fullerenos - Puntos clave
- Los fullerenos son alótropos del carbono.
- Los alótropos son diferentes formas estructurales en las que puede existir el mismo elemento.
- Las moléculas defullereno tienen estructuras huecas.
- Los fullerenos suelen tener anillos hexagonales de Carbono como estructura básica, pero también pueden tener anillos pentagonales de Carbono.
- El Buckminsterfullereno (C60) es un fullereno con 60 átomos de Carbono.
- La estructura del Buckminsterfullereno se denominaicosaedro truncado. Es una forma esférica formada por 20 polígonos hexagonales y 12 polígonos pentagonales. Cada vértice de cada polígono tiene un átomo de carbono; y cada arista de cada polígono es un enlace entre los átomos de carbono.
- Losnanotubos de carbono son fullerenos que tienen forma cilíndrica.
- Los nanotubos de carbono tienen anillos hexagonales de carbono como estructura básica.
- Además de las propiedades comunes de los fullerenos, los nanotubos de carbono tienen una gran resistencia a la tracción, lo que los hace útiles en muchas más aplicaciones.










