Así que, si te interesa saber más sobre los tampones, ¡vamos a sumergirnos en el mundo de la preparación de tampones!
- Este artículo trata sobre la preparación de tampones.
- En primer lugar, hablaremos de cómo preparar un tampón y también veremos la valoración.
- Después, aprenderemos el procedimiento de preparación de tampones.
- Después, veremos la preparación de tampones y la estandarización.
- Por último, conoceremos la preparación de formol neutro tamponado.
Definición de tampón
En primer lugar, definamos qué es una solución tampón.
Un tampón es una solución capaz de resistir los cambios de pH cuando se le añaden pequeñas cantidades de ácido o bases.
Una solución tampón suele consistir en una mezcla de un ácido débil y su sal, o de una base débil y su sal. Los tampones ácidos son los que tienen un pH inferior a 7, mientras que un tampón básico tiene un pH superior a 7.
Los tampones actúan eliminando los iones hidrógeno (H+) o hidróxido (OH-) que se le añaden, ¡evitando que cambie el pH! Pero, ¿cómo lo consiguen exactamente los tampones? Veámoslo.
Supongamos que tienes una solución amortiguadora CH3COOH/CH3COO-. El ácido acético es un ácido débil, por lo que se trata de un tipo de tampón ácido.
$$CH_{3}COOH_{(aq)}+H_{2}O_{(l)}\rightleftharpoons CH_{3}COO^{-}+H^{+}_{(aq)}$$
Si añades una pequeña cantidad de ácido fuerte a este tampón, los iones acetato (CH3COO-) del tampón se combinarán con los iones hidrógeno (H+) recién añadidos y crearán más ácido acético. Cuando esto ocurre, la solución tampón elimina la mayor parte de los nuevos iones hidrógeno, evitando que el pH sufra cambios significativos.
Ahora, si añades una pequeña cantidad de una base fuerte a este tampón, ¡el tampón eliminará la mayoría de los iones OH- añadidos reaccionando con H+ para formar agua!
Los tampones básicos funcionan de forma similar. Un ejemplo habitual de tampón básico es una solución tampón NH3/NH4+.
$$NH_(3_(aq)}+H_{2}O_(l)} es decir, NH_(4_(aq)}^{+}+OH^{-}_(aq)}$$$
Si añades una pequeña cantidad de ácido fuerte, los iones hidróxido (OH-) del tampón se combinarán con los iones hidrógeno (H+) recién añadidos para formar agua. Si añades una pequeña cantidad de una base fuerte a este tampón, el tampón eliminará la mayoría de los iones OH- añadidos haciendo reaccionar el NH4+ para formar NH3.
pH y pKa
El pH se define como una medida de la concentración de iones [H+] en una solución. Cuando se trata de tampones, podemos utilizar la ecuación de Henderson-Hasselbalch para calcular el pH.
$$pH=pKa+log_{10}\frac{[A^{-}]}{[HA]}$$
donde la concentración de la especie aniónica (con carga negativa) es [A-], la concentración del ácido es [HA] y el logaritmo negativo de la constante de disociación del ácido es pKa. ¡Veamos un ejemplo!
Calcula el pH de un tampón compuesto por 0,10 M de HA y 0,075 M de NaA. (Ka = 2,5 x 10-6); donde, un ácido se simboliza por, HA, la sal del ácido se simboliza por, NaA, y la constante de disociación del ácido es,Ka:
En primer lugar, debemos utilizar el valor deKa para calcular pKa.
$$pKa=-log_{10}(2.5\cdot 10^{-6})=5.6$$
Ahora, podemos utilizar la fórmula anterior para calcular el pH de la solución tampón.$$pH=5,60+log_{10}\frac{[0,075]}{0,10}$$$$pH=5,48$$
pKa es el logaritmo negativo de la constante de disociación del ácido, conocida comoKa. Los químicos utilizan esta constante de disociación ácida para determinar la fuerza de un ácido, ya que mide su capacidad de disociarse en el agua. Cuanto mayor sea laKa de un ácido, ¡más fuerte será!
$$Ka=\frac{[products]}{[reactants]}=\frac{[H^{+}]\cdot [A^{-}]}{[HA]}$$
$$pKa=-logKa$$
Preparación de tampones y valoración
Ahora que sabemos cómo funcionan los tampones, veamos cómo se preparan. Hay tres formas de preparar una solución tampón:
| Solución tampón |
| Ácido débil / Base conjugada |
| Base débil / Ácido fuerte |
| Ácido débil / Base fuerte |
La primera forma consiste en mezclar un ácido con su base conjugada manteniendo iguales las concentraciones de ambos componentes. Por ejemplo, un tampón que contenga 0,10 M de HClO y 0,10 M de NaClO (aq).
La segunda forma consiste en mezclar una base débil con un ácido fuerte. Este tampón debe tener una cantidad mayor de la especie débil que de la fuerte. Por ejemplo, un tampón formado por 1,0 M de HCl mezclado con 1,25 M de NH3.
Otra forma de preparar una solución tampón es mezclando un ácido débil con una base fuerte. Del mismo modo, este tampón también debe tener una mayor cantidad de la especie débil en comparación con la fuerte. Por ejemplo, un tampón que contenga 1,50 moles del oxiácido débil HNO2 y 1,25 moles del ácido fuerte NaOH.
A la hora de decidir qué tampón utilizar, la mejor opción es preparar un tampón que tenga el pKa más cercano al pH deseado. Pongamos esto en práctica.
Necesitas una solución tampón con un pH de alrededor de 5. ¿Cuál de las siguientes combinaciones elegirías para preparar el tampón?
- HIO3 + KIO3
- HCN + KCN
- HNO2 + KNO2
- HIO4 + NaIO4
Utiliza los valoresKa que aparecen a continuación.
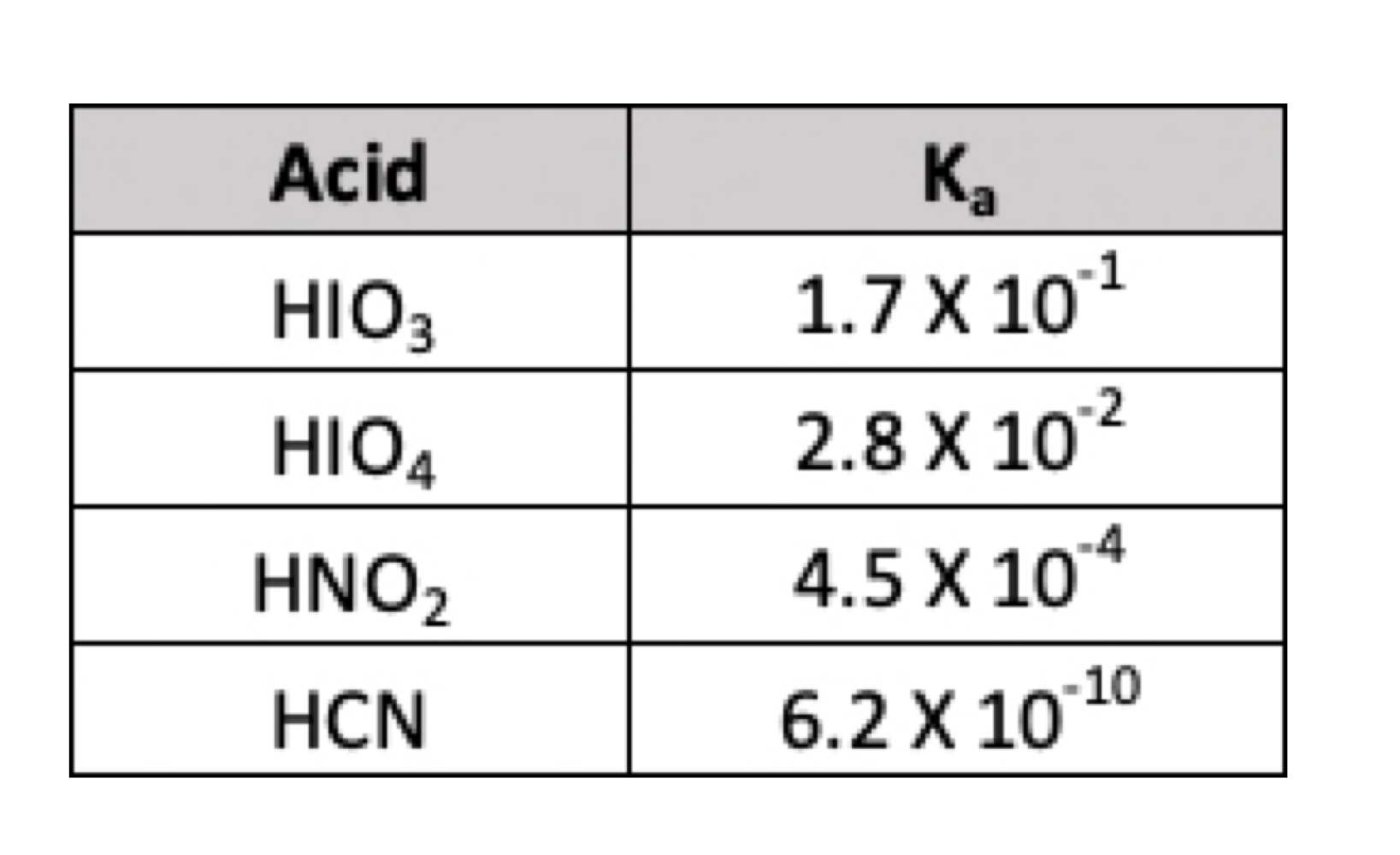
Constante de disociación de ácidos para diferentes ácidos, Isadora Santos - StudySmarter Originals.Aunque parece un problema complicado, ¡en realidad es sencillo de resolver! Antes dijimos que el mejor tampón sería el que tuviera un pKa cercano al valor de pH deseado (en este caso, un pH de 5). Así pues, sigamos adelante y utilicemos losvalores Ka para calcular el pKa.
$$pKa=-log_{10}Ka$$
$$pKa de HIO_{3}=-log_{10}(1,7\cdot 10^{-1})=0,77$$
$$pKa de HIO_{4}=-log_10}(2,8\cdot 10^{-2})=1,55$$
$$pKa de HNO_{2}=-log_10}(4,5\cdot 10^{-4})=3,35$$
$$pKa de HCN=-log_{10}(6,2\cdot 10^{-10})=9,21$$
En este caso, el pKa más cercano a pH 5 es el pKa del HNO2. Por tanto, optaríamos por preparar un tampón que contuviera HNO2 +KNO2.
Las soluciones tampón también se ven en las valoraciones. Durante una valoración, se añade una solución de concentración conocida a la solución de concentración desconocida hasta alcanzar el punto final de la valoración. Puedes aprender más sobre las valoraciones leyendo"Tipos de valoraciones ácido-base".
La valoración es un proceso utilizado en química para determinar la concentración desconocida de una solución concreta combinándola con una solución de concentración conocida.
Como ejemplo, veamos la valoración de 50,0 mL de un ácido acético 0,1 M, CH3COOH(aq) con NaOH 0,1 M (aq). Observa que se trata de un ejemplo de valoración de un ácido débil con una base fuerte.
- Al inicio de la valoración, la solución sólo contiene CH3COOH(aq) y tiene un pH de 2,89.
- Entre el pH inicial y el punto de equivalencia, se añade NaOH gota a gota a la solución, y los iones hidróxido (OH-) añadidos convierten el CH3COOH(aq) en CH3COO- ( aq), ¡formando una solución tampón!
- En el punto de equivalencia, el ácido queda completamente neutralizado por la base añadida (moles de ácido = moles de base), lo que da lugar a la formación de la solución salina CH3COONa(aq).
- Después del punto de equivalencia, ya no queda ácido para reaccionar con el exceso de OH-.
Procedimientos de preparación de tampones
Veamos ahora el procedimiento para preparar una solución tampón de pH conocido.
Paso 1. El primer paso en la preparación de una solución tampón es elegir el par ácido-base conjugado que mejor se adapte a tus necesidades. Por ejemplo, si necesitaras preparar una solución tampón de pH 6,3, elegirías un ácido con un pKa lo más cercano posible al del pH deseado. Para ello, calculamosKa y luego buscamos un ácido con un valorKa próximo alKa calculado, y un valor pKa próximo a 6,3.
$$pKa=-logKa$$
$$Ka=10^{-pKa}$$
$$Ka=10^{-6.3}=5.01\cdot 10^{-7}$$
El ácido carbónico (H2CO3) tiene unvalor Ka de 4,4 x 10-7 y un pKa1 de 6,37, por lo que sería una gran elección de ácido débil para nuestro tampón. Para suministrar los iones hidrogenocarbonato, podemos elegir una sal como el hidrogenocarbonato sódico (NaHCO3).
Paso 2. Tras elegir los componentes de nuestra solución tampón (H2CO3/NaHCO3), tenemos que calcular la proporción de los componentes del tampón reordenando la ecuación de Henderson-Hasselbalch.
$$pH=pKa+log\frac{[HCO_{3^{-}}]}{H_{2}CO_{3}}$$
$$6.30=6.37+log\frac{[HCO_{3^{-}}]}{H_{2}CO_{3}}$$
$$6.30-6.37=log\frac{[HCO_{3^{-}}]}{H_{2}CO_{3}}$$
$$10^{-0.07}=log\frac{[HCO_{3^{-}}]}{H_{2}CO_{3}}$$
$$\frac{[HCO_{3^{-}}]}{H_{2}CO_{3}}=\frac{0.85}{1}$$
Así, por cada mol de H2CO3 en 1 L de solución, necesitaremos 0,85 moles de NaHCO3.
Paso 3. Ahora que tenemos la proporción de los componentes, podemos utilizarla para calcular la concentración de la solución tampón. Supongamos que en tu laboratorio tienes una reserva de H2CO3 0,5 M. Podemos utilizarlo para calcular la cantidad de NaHCO3 necesaria para mezclar con el ácido débil y crear una solución tampón con un pH de 6,3.
Primero, calcula los moles de ácido carbónico.
$$Mol\ H_{2}CO_{3}=1,0L\cdot \frac{0,5mol\ H_{2}CO_{3}}{1,0L}=0,5 moles\ H_{2}CO_{3}$$
A continuación, utiliza la relación tampón del paso 2 para hallar los moles de NaHCO3 a partir de los moles de H2CO3.
$$Mol de NaHCO_{3}=0,5 moles de H_{2}CO_{3}\cdot frac {0,85 mol de NaHCO_{3}}{1,0 mol de H_{2}CO_{3}}=0,43NaHCO_{3}$$.
Después, convierte los moles de NaHCO3 en masa (en gramos).
$$g\ NaHCO_{3}=0,43\mol\ NaHCO_{3}\cdot \frac{84,006g\ NaHCO_{3}}{1,0mol\ NaHCO_{3}}=36,12g\ NaHCO_{3}$$
¡Ahora sabemos exactamente cuánto NaHCO3 tenemos que añadir a nuestro H2CO3 para obtener una solución tampón de 1 L!
Paso 4. El último paso del procedimiento de preparación del tampón es ¡mezclar los componentes! Primero, tenemos que pesar 36,12 g de NaHCO3y disolverlo en suficiente H2CO3 0,5 M. Una vez disuelto, tenemos que añadir mássolución de H2CO30,5 M hasta obtener un volumen de 1,0 L.
Para asegurarnos de que el pH es correcto, podemos utilizar un pH-metro. Si el pH es ligeramente superior, añade un par de gotas de un ácido fuerte hasta alcanzar el pH deseado. Si el pH es un poco más bajo de lo esperado, añade unas gotas de una base fuerte hasta alcanzar el pH deseado.
¡Enhorabuena! ¡Acabas de hacer una solución tampón H2CO3/HCO3- con un pH de 6,3!
Preparación de tampones y normalización
Hablemos de la normalización. Las soluciones tampónestándar son soluciones tampón de pH estándar. Las soluciones tampón estándar tienen distintos valores de pH y pueden prepararse combinando distintas soluciones. Por ejemplo, podemos hacer una disolución amortiguadora de ácido clorhídrico con un pH de 1,2 mezclando 50 ml de KCl 0,2M con 85,0 ml de HCl 0,2M en un matraz aforado de 200 ml, ¡y luego añadir agua hasta el volumen!
Podemos utilizar soluciones tampón estándar para calibrar un pH-metro. Por ejemplo, durante la calibración de un medidor de pH utilizando soluciones tampón normalizadas con pH 7 y pH 2, se coloca el electrodo del medidor de pH en las soluciones tampón de pH 7 y luego se deja calibrar. Después se hace lo mismo con el tampón de pH 2.
Preparación de Formalina tamponada neutra
¿Has oído hablar de la formalina? La formalina es una solución que se utiliza como fijador para la conservación de especímenes biológicos. A bajas concentraciones, la formalina es bacteriostática, lo que significa que inhibe el crecimiento de microorganismos, pero no los mata.
Una forma de preparar una Formalina tamponada neutra al 10% a partir de soluciones madre es mezclar 100 .0mL de una solución madre de formaldehído al 37%, 900.0 mL de agua destilada, 4.0 g de NaH2PO4
Ahora, ¡espero que te sientas más seguro a la hora de preparar tampones!
Preparación de tampones - Puntos clave
- Un tampón es una solución capaz de resistir los cambios de pH cuando se le añaden pequeñas cantidades de ácidos o bases.
- Los tampones actúan eliminando los iones hidrógeno (H+) o hidróxido (OH-) que se le añaden, impidiendo que cambie el pH.
- Al decidir qué tampón utilizar, la mejor opción es preparar un tampón que tenga el pKa más cercano al pH deseado.
- Hay tres formas de preparar una solución tampón: 1) Ácido débil / Base conjugada, 2) Base débil / Ácido fuerte y 3) Ácido débil / Base fuerte.
Referencias
- "Laboratorios de Indagación para Química AP®: Los tampones en los productos domésticos". FlinnPREP, www.flinnprep.com/Chapter?courseFriendlyUrl=Chemistry_Inquiry_Lab&unitFriendlyUrl=Buffers_in_Household_Products&chapterTitle=Buffers_in_Household_Products.
- "Búferes - Vídeo de Química Analítica". Clutch Prep, www.clutchprep.com/analytical-chemistry/buffers.
- "¿Cómo preparar desde cero una solución tampón de PH conocido?" Master Concepts in Chemistry, masterconceptsinchemistry.com/index.php/2018/11/01/how-do-you-prepare-a-buffer-solution-of-known-ph-from-scratch/.
- "Preparación de soluciones tampón : Directrices Farmacéuticas". Pharmaguideline, www.pharmaguideline.com/2010/09/preparation-of-buffer-solutions.html.
- "Calibración del medidor de PH". Purdue.edu, 2019, chemed.chem.purdue.edu/genchem/lab/equipment/phmeter/use.html.
- Rosenthal, Patrick R. Microbiología Médica. S.L., Elsevier - Ciencias de la Salud, 2020.
- "Química de la fijación con formol - QED Bioscience Inc". QED Bioscience Inc, 14 de junio de 2018, www.qedbio.com/blog/chemistry-of-formalin-fixation/.
- Manual de tinción de patología quirúrgica - Fijación con formol. Webpath.med.utah.edu.
- Theodore Lawrence Brown, et al. Química : La Ciencia Central. 14ª ed., Harlow, Pearson, 2018.
- Moore, John T, y Richard Langley. McGraw Hill : Química AP, 2022. Nueva York, Mcgraw-Hill Education, 2021.








