En este artículo aprenderemos todo sobre la presión de vapor: qué es, qué factores influyen en ella y cómo calcularla.
- Este artículo trata sobre la presión de vapor.
- En primer lugar, definiremos la presión de vapor y aprenderemos cómo se produce.
- A continuación, conoceremos los factores que influyen en ella.
- A continuación, hablaremos de la presión de vapor del agua y de cómo afecta a lahumedad relativa .
- Por último, aprenderemos a calcular la presión de vapor en distintas situaciones.
Definición de presión de vapor
Empecemos por ver la definición de presión de vapor.
Cuando un líquido y su forma gaseosa se encuentran en un recipiente cerrado, la presión ejercida por el gas se denomina presión de vapor .
Cuando un líquido y su gas están en un recipiente cerrado, existen en equilibrio. Independientemente de la temperatura, algunas partículas del líquido tendrán energía suficiente para entrar en la fase gaseosa.
Causas de la presión de vapor
Exploremos ahora las causas de la presión de vapor. La presión de vapor se debe a que las partículas de gas chocan con las paredes del recipiente. He aquí un diagrama ilustrativo:
 Las partículas de gas chocan con el recipiente para crear presión de vapor. StudySmarter Original.
Las partículas de gas chocan con el recipiente para crear presión de vapor. StudySmarter Original.
Al estar en equilibrio, el líquido se evapora en gas y el gas se condensa en líquido.
Cuando la presión de vapor es igual a la presión atmosférica, se produce la ebullición. Como el líquido no está "retenido" por la presión atmosférica, el líquido puede escapar y dispersarse como gas.
Factores que afectan a la presión de vapor
Hay dos factores principales que afectan a la presión de vapor. Son los siguientes: 1. Temperatura 2. Tipo de molécula. Tipo de molécula
Si aumenta la temperatura, aumentará la presión de vapor. Esto se debe a que más moléculas tienen energía para escapar de la fase líquida a la fase gaseosa.
El tipo de moléculatambién afectará a la presión de vapor. Más concretamente, las fuerzas entre las moléculas afectan a la presión de vapor. Cuando las moléculas tienen fuerzas fuertes entre ellas, la presión de vapor es baja, ya que estas fuerzas dificultan que las moléculas se conviertan en gas. Paraque un líquido se convierta en gas, las fuerzas entre las moléculas se rompen, por lo que cuanto más fuertes sean las fuerzas, más difícil será que se convierta en gas.
Presión de vapor del agua
Cuando hablamos de presión de vapor, a menudo nos referimos al agua. La presión de vapor suele utilizarse de dos formas:1. Determinaciónd el punto de ebullición 2. Humedad relativa Humedad relativaCuando nos referimos al punto de ebullicióndel agua, normalmente hablamos del punto de ebullición a 1 atm (presión atmosférica a nivel del mar). Sin embargo, este punto de ebullición cambia dependiendo de cuál sea la presión atmosférica, ya que la ebullición se produce cuando la presión de vapor = presión atmosférica. Por ejemplo, a 3.000 metros (unos 3 km) sobre el nivel del mar, la presión atmosférica es de sólo 0,69 atmósferas. Como hay menos "empuje" de la atmósfera, el punto de ebullición disminuye.
Lahumedad relativatambién está relacionada con la presión de vapor.
La humedadrelativa es la relación entre la presión parcial (cuánta presión aporta una especie) del agua y la presión de vapor de equilibrio. La fórmula es: $$\text{Humedad relativa}=\frac{text{presión parcial}}{text{presión de vapor}} * 100\%$$
La humedad relativa nos dice cuánto vapor de agua hay en el aire frente a cuánto puede "retener" el aire a esa temperatura. Si alguna vez has visto la humedad expresada en porcentaje, esto es lo que significa. Pongamos un ejemplo.
A 25°C, la presión de vapor del agua es de 0,0313 atm. Si la presión parcial del vapor de agua en el aire es de 0,0211 atm, ¿cuál es la humedad relativa?
Para calcular la humedad relativa, basta con dividir la presión de vapor por la presión parcial del vapor de agua.
$$\text{Humedad relativa}=\frac{\text{presión parcial}}{\text{presión de vapor}} * 100\%$$
$$\text{Relative humidity}=\frac{0.0211\,atm}{0.0313\,atm}*100\%=67.4\%$$
Fórmulas de presión de vapor
Hay tres fórmulas principales asociadas a la presión de vapor:1. Clausius-Clapeyron 2. Ley de Raoult Ley deRaoult 3.Ley de Henry
Empecemos por la fórmula de Clausius-Clapeyron.
La fórmula de Clausius-Clapeyron muestra la relación entre la presión de vapor y la temperatura. La fórmula es: $$ln\frac{P_2}{P_1}=\frac{\Delta H_{vap}}{R}(\frac{1}{T_1}-\frac{1}{T_2})$$Donde: P1 es la presión parcial en T1, P2 es la presión parcial en T2, ΔHvap es la entalpía de vaporización (energía neta que se necesita para pasar de líquido a gas) y R es la constante de los gases ideales.
Solemos utilizar esta fórmula para calcular el cambio en la presión de vapor debido a un cambio de temperatura. Aquí tienes un gráfico para el agua:
 La presión de vapor del agua aumenta con la temperatura. StudySmarter
La presión de vapor del agua aumenta con la temperatura. StudySmarter
El aumento de la presión de vapor es exponencial, de modo que cuanto mayor sea la temperatura, mayor será el cambio en la presión de vapor. Clausius-Clapeyronpuede utilizarse exclusivamente para sustancias puras.
Si queremos analizar la presión de vapor de una mezcla, ahí es donde entra en juego la ley de Raoult.
Laley de Raoult se utiliza para calcular la presión de vapor total de una solución compuesta por dos o más líquidos con presiones de vapor diferentes. La fórmula es
$$P_{total}=\suma_{i} P_i \chi_i $$
DondePi es la presión de vapor de una sustancia determinada y χi es la fracción mol arde esa sustancia.
La fracción molar es la relación entre una sustancia y toda la solución. Lafórmula es: $$\chi=\frac{n_i}{n_{tot}}$$
Dondeni es el número de moles de una sustancia y ntot es la cantidad total de moles de la solución.
Aquí tienes un gráfico que muestra cómo funciona la ley de Raoult.
 La presión de vapor cambia en función de la fracción molar. StudySmarter Original.
La presión de vapor cambia en función de la fracción molar. StudySmarter Original.
En el diagrama ocurren muchas cosas, así que vamos a desglosarlo.
La línea rosa representa la presión parcial de la especie A. A la izquierda, la fracción molar de A es uno, por lo que toda la solución es sólo A. Esto significa que la presión total es igual a la presión de vapor pura de A (PA°). A medida que disminuye la fracción molar de A, la presión parcial también disminuye hasta que es 0.
La línea verde es la presión parcial de la especie B. A la derecha, la fracción molar de B es uno, por lo que toda la solución es B. Esto significa también que Ptotal=PB°. La presión parcial disminuye a medida que te desplazas hacia la izquierda, ya que la fracción molar también disminuye.
Por último, la línea negra es la presión total. Como ya hemos dicho, si sólo está presente una especie, la presión total es igual a la presión de vapor de esa sustancia pura.
Nuestra última fórmula es la ley de Henry .
Laley de Henry se utiliza cuando un líquido contiene un soluto (especie disuelta). Esta ley puede utilizarse tanto para solutosno volátiles (no se evaporan) como volátiles (se evaporan). La fórmula es
$$C=(K_H)P_{gas}$$
Donde KH es la constante de Henry, C es la solubilidad, la concentración o la fracción molar del gas, y P es la presión del gas.
Las unidades/valor de la constante de Henry dependen de lo que represente C.
Aunque C puede representar varias cosas diferentes, la relación entre C y P sigue siendo la misma. La solubilidad, la fracción molar y la concentración nos dicen lo mismo: qué cantidad de soluto hay en el líquido. La relación entre C y P depende de si el soluto es volátil o no.Aquí tienes un diagrama que muestra estas relaciones:
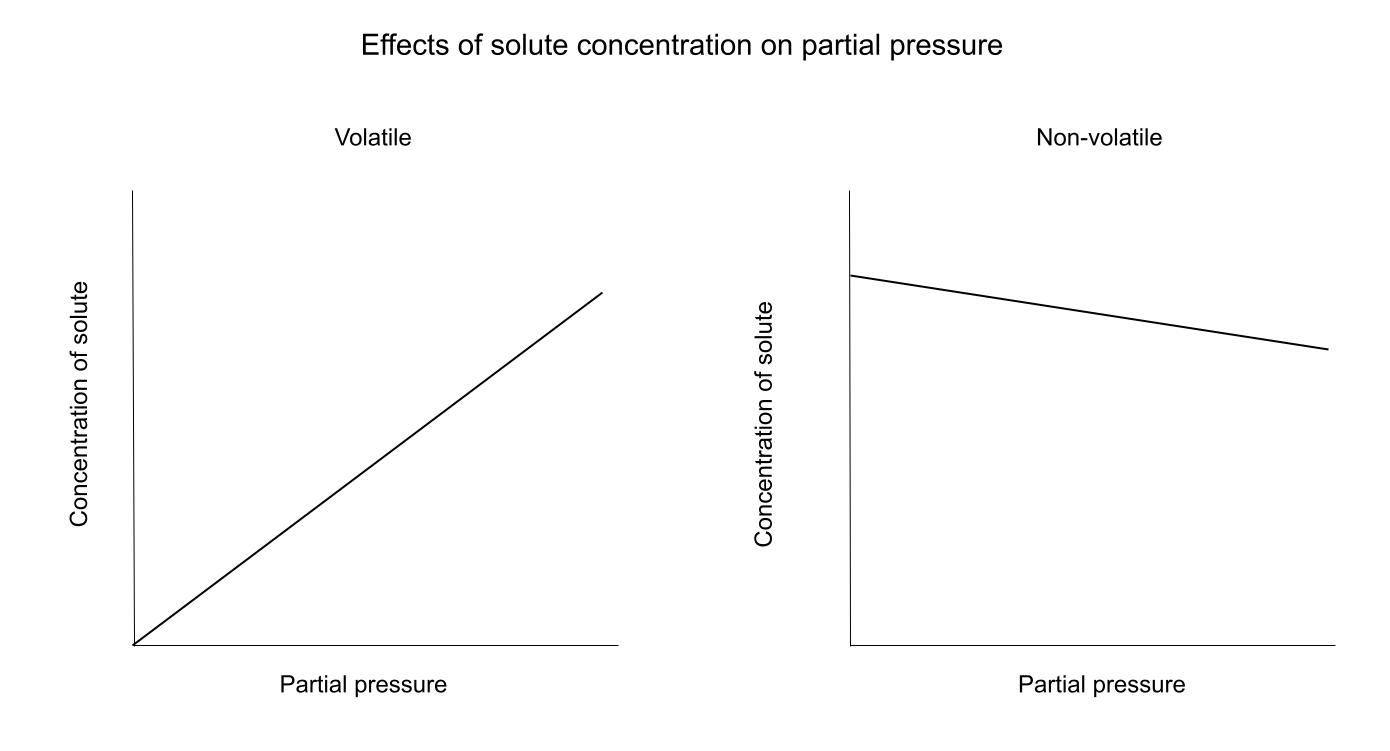
Para un soluto volátil, un aumento de C (todos los tipos) conlleva un aumento de la presión. Esto se debe a que cuantas más partículas volátiles haya en la solución, más partículas podrán evaporarse y convertirse en gas.Para un solutono volátil, la relación es la contraria. Las partículas de soluto "estorban" el camino de la partícula de disolvente hacia la superficie para convertirse en gas. Piénsalo como caminar entre una multitud: cuanta más gente haya, más difícil será encontrar un camino fácil hacia tu destino.
La ley de Henry puede explicar una enfermedad llamada "bends" (enfermedad de descompresión). Cuando un submarinista se sumerge en el océano, la presión aumenta. Este aumento de presión hace que gases como el nitrógeno sean más solubles en la sangre. Si un buceador asciende demasiado deprisa, el rápido cambio de presión hace que estos gases se condensen rápidamente y formen burbujas.
Estas burbujas pueden hacer que estallen los vasos sanguíneos, lo que provoca "el síndrome del buzo doblado" y mucho dolor y problemas médicos para el buceador. Para evitarlo, los buceadores ascienden lentamente para que el gas de la sangre pueda equilibrarse con la presión externa, evitando estas burbujas.
Ejemplos de presión de vapor
Ahora que hemos cubierto las diferentes ecuaciones, trabajemos con algunos ejemplos.
La presión de vapor del agua a 303 K es de 0,0418 atm. ¿Cuál es la presión de vapor del agua a 363 K? La entalpía de vaporización (ΔHvap) del agua es de 44.000 J/mol y la constante de los gases es de 8,315 J/molK.Como estamos estudiando la variación de la presión con la temperatura, utilizaremos lafórmula de Clausius-Clapeyron . Sólo tenemos que introducir nuestros valores y resolver P2.
$$ln\frac{P_2}{P_1}=\frac{\Delta H_{vap}}{R}(\frac{1}{T_1}-\frac{1}{T_2})$$ xml-ph-0000@deepl.internal $$ln\frac{P_2}{0.0418\,atm}=\frac{44,000\frac{J}{mol}}{8.315\frac{J}{molK}}(\frac{1}{303\,K}-\frac{1}{363\,K})$$ xml-ph-0000@deepl.internal $$ln\frac{P_2}{0.0418,atm}=(5,291\,K)(0,000546\,K^{-1})$$$$ln\frac{x}{y}=ln(x)-ln(y)\,\text{(regla que usamos para simplificar la ecuación)}$$$$ln(P_2)-ln(0.0418\,atm)=2,89$$$$ln(P_2)=2,89+(-3,17)$$$$e^{ln(P_2)}=e^{-0,28}$$$$P_2=0,756\,atm$$
Una disolución está formada por 0,35 mol de agua, 0,62 mol de etanol y 0,15 mol de butanol. Las presiones parciales a 298 K son (en orden): 0,0313 atm, 0,0579 atm y 0,0893 atm. ¿Cuál es la presión de vapor total de la solución?
Como se trata de una disolución de tres líquidos, utilizaremos la ley de Raoult. Nuestro primer paso es calcular la fracción molar de cada especie.
$$\chi_i=\frac{n_i}{n_{tot}}$$ xml-ph-0000@deepl.internal $$n_{tot}=0.35\,mol+0.62\,mol+0.15\,mol=1.12\,mol$$ xml-ph-0001@deepl.internal $$\chi_{water}=\frac{0.35\,mol}{1.12\,mol}=0.313$$ xml-ph-0000@deepl.internal $$\chi_{ethanol}=\frac{0.62\,mol}{1.12\,mol}=0.554$$ xml-ph-0001@deepl.internal $$\chi_{butanol}=\frac{0.15\,mol}{1,12\,mol}=0,133$$A continuación, multiplicamos la presión parcial de cada especie por su fracción molar y sumamos estos valores para obtener la presión de vapor total.$$P_{total}=\sum_{i} P_i \chi_i $$$$P_{total}=(P_{water}* \chi_{water})+(P_{ethanol}* \chi_{ethanol}+(P_{butanol}* \chi_{ethanol})$$$$P_{total}=(0.0313\,atm*0.313)+(0.0579\,atm*0.554)+(0.0893\,atm*0.133)$$ xml-ph-0000@deepl.internal $$P_{total}=0.0538\,atm$$
En una botella de 2 L de gaseosa, la concentración deCO2 disuelto es de 0,0875 M. Si la constante de la ley de Henry parael CO2 a 25 °C es de 3,1x10-2 M/atm, ¿cuál es la presión parcial delCO2?
Como estamos hablando de un soluto (CO2), utilizaremos la ley de Henry . Todo lo que tenemos que hacer es introducir nuestras variables y resolver para la presión.
$$C=(K_H)P_{gas}$$
$$P_{gas}=\frac{C}{K_H}$$ xml-ph-0000@deepl.internal $$P_{gas}=\frac{0.0875\,M}{3.1x10^{-2}\frac{M}{atm}}$$
$$P_{gas}=2.82\,atm$$
Presión de vapor - Puntos clave
- Cuando un líquido y su estado gaseoso se encuentran en un recipiente cerrado, la presión ejercida por el gas se denomina presión de vapor .
- La presión de vapor se debe al choque de las partículas de gas con las paredes del recipiente.
- Hay dos factores principales que afectan a la presión de vapor:1. Temperatura (aumento de la temperatura = aumento de la presión)2. Tipo de molécula (cuanto más fuertes sean las fuerzas entre moléculas, más débil será la presión de vapor)
- Lahumedad relativa es la relación entre la presión parcial (cuánta presión aporta una especie) del agua y la presión de vapor de equilibrio. La fórmula es: $$\text{Humedad relativa}=\frac{text{presión parcial}}{text{presión de vapor}} * 100\%$$
- La fórmula de Clausius-Clapeyron muestra la relación entre la presión de vapor y la temperatura. La fórmula es:$$ln\frac{P_2}{P_1}=\frac{\Delta H_{vap}}{R}(\frac{1}{T_1}-\frac{1}{T_2})$$
- La ley de Raoult se utiliza para calcular la presión de vapor total de una solución compuesta por dos o más líquidos con presiones de vapor diferentes. La fórmula es
$$P_{total}=\suma_{i} P_i \chi_i $$
Laley de Henry se utiliza cuando un líquido contiene un soluto (especie disuelta). Esta ley puede utilizarse tanto para solutos no volátiles (no se evaporan) como volátiles (se evaporan). La fórmula es
$$C=(K_H)P_{gas}$$











