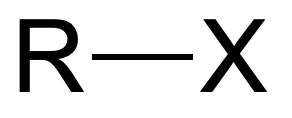Facilidad relativa de hidrólisis de cloruros de acilo, cloruros de alquilo y cloruros de arilo
La hidrólisis es la reacción química de un compuesto con el agua, en la que se produce la descomposición tanto del compuesto como del agua. La facilidad de la hidrólisis difiere en los distintos compuestos. Si comparamos los cloruros de alquilo, los cloruros de acilo y los cloruros de arilo, el orden de facilidad de hidrólisises - Cloruro de acilo > cloruro de alquilo > cloruro de arilo
Los cloruros de arilo no sufren hidrólisis. Esto puede explicarse por la fuerza del enlace carbono-cloro.
Cloruros de acilo
 Fig. 10: Haluro de acilo | StudySmarter Originals
Fig. 10: Haluro de acilo | StudySmarter Originals
La hidrólisis de los halogenuros de acilo es más fácil en comparación con los halogenuros de alquilo y los halogenuros de arilo, y puede realizarse a
temperatura ambiente. Esto se debe a que el carbono al que está unido el haluro, también está unido a un átomo de oxígeno. Tanto el átomo de oxígeno como el átomo de haluro son muy electronegativos y alejan los electrones del átomo de carbono. Como resultado, el átomo de carbono
queda muy δ+. Esto hace que el enlace C-X sea débil, convirtiéndolo en un lugar fácil de atacar por un nucleófilo.
Haluros de alquilo
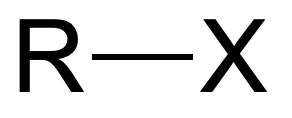
Fig. 11: Haluro de alquilo | StudySmarter Originals
En los halogenuros de alquilo sólo hay un átomo electronegativo, el halógeno, que aleja electrones del átomo de carbono al que está unido. Por tanto, el átomo de carbono no es tan δ+, y el enlace C-X es más fuerte que el de los halogenuros de acilo. Por lo tanto, la hidrólisis de los halogenuros de alquilo necesita calentarse, y también refluir con OH-, que es un nucleófilo más fuerte que el H2O.
Haluros de arilo
El enlace C-X de los halogenuros de arilo es el más fuerte. Esto se debe a que un par solitario de electrones en el átomo de haluro forma parte del enlace 𝜋 deslocalizado. Esto hace que el enlace C-X desarrolle algunas características de doble enlace. Por lo tanto, no se produce la hidrólisis de los haluros de arilo.
Veamos las estructuras de resonancia que presentan los halogenuros de arilo en el ejemplo del cloruro de arilo.
 Fig. 12: Estructuras de resonancia del cloruro de arilo | Cliffs Notes
Fig. 12: Estructuras de resonancia del cloruro de arilo | Cliffs Notes
Como puedes ver en el diagrama de las estructuras de resonancia, 3 de las 4 estructuras de resonancia tienen un doble enlace entre el átomo de carbono y el átomo de cloro. Por lo tanto, en la estructura híbrida, hay algunas características de doble enlace en el enlace C-X.